انگشتان دست و پا
بیشتر ملانومهای زیر ناخن، انگشت شست پا یا شست را درگیر میکنند. ملانومایی که روی پوست انگشت یا زیر ناخن قرار دارد، با برش وسیع برداشته میشود و ضایعات دیستال انگشت معمولاً با قطع عضو جزئی همزمان انگشت همراه است که سطح آن با وسعت تومور و محل آن تعیین میشود. به طور کلی، قطع عضو در مفصل بین انگشتی دیستال یا میانی انگشتان یا پروگزیمال به مفصل بین انگشتی شست انجام میشود. قطع عضوهای پروگزیمالتر با بهبود بقا همراه نیستند. برای ملانومهای انگشت شست، قطع عضو معمولاً میتواند پروگزیمال به مفصل بین انگشتی انجام شود. ملانوما که بین دو انگشت ایجاد میشود، معمولاً با برش وسیع و بازسازی نقص با فلپ یا پیوند پوست قابل درمان است.
کف پا
برداشتن ملانوم روی سطح کف پا اغلب نقص قابل توجهی در ناحیه تحمل وزن ایجاد میکند. در صورت امکان از نظر انکولوژیکی، فاسیای عمیق روی تاندونهای اکستانسور باید به عنوان پایهای برای پوشش پیوند پوست حفظ شود. یک فلپ کف پا، که میتواند به صورت جانبی یا داخلی بالا برده شود، میتواند بافت موضعی با عروق خوب را برای نواحی تحمل وزن فراهم کند، در عین حال که مقداری حس نیز ایجاد میکند. بستن مرحلهای برخی از ملانومهای کف پا، به ویژه پاشنه، با استفاده اولیه از دستگاه بستن با کمک خلاء برای تحریک بافت گرانولاسیون و به دنبال آن استفاده از پیوند پوست مرحلهای انجام شده است. چنین رویکردی اغلب نیاز به بازسازی پیچیده را برطرف میکند و اساساً نیاز به بازسازی گسترده فلپ پاشنه را از بین برده است.
صورت
به دلیل ملاحظات عملکردی و زیبایی متعدد، ضایعات صورت اغلب نمیتوانند با حاشیه بیش از 1 سانتیمتر برداشته شوند. قطر تومور، ضخامت تومور و محل تومور باید هنگام برنامهریزی برای عرض حاشیه در نظر گرفته شوند. پرتودرمانی میتواند به عنوان یک درمان کمکی در نظر گرفته شود، زمانی که حاشیهها نزدیکتر از حد مطلوب باشند.
برخی از جراحان پوست، به ویژه برای ملانوم بدخیم لنتیگو صورت، روش جراحی میکروسکوپی موهس را به عنوان روشی برای برداشتن ملانوم با حداقل حاشیه جراحی پیشنهاد کردهاند. با این تکنیک، برداشتن ضایعه با ارزیابیهای بافتشناسی سریالی تا زمان برداشتن کامل ضایعه انجام میشود. در حال حاضر، دادههای کمی برای حمایت از رویکرد جراحی میکروسکوپی موهس به جای رویکرد جراحی استاندارد وجود دارد.
پستان
برداشتن وسیع با بسته شدن اولیه، درمان انتخابی برای ملانوم روی پوست پستان است. ماستکتومی معمولاً توصیه نمیشود.
ناف
ملانومهای نزدیک یا داخل ناف ممکن است نیاز به برداشتن ناف داشته باشند. در این موارد، اغلب میتوان از فلپهای چرخشی برای بازسازی ناف استفاده کرد.
ملانوم مخاطی
بیماران مبتلا به ملانوم مخاطی واقعی – از جمله ملانوم مخاط دستگاه تنفسی، واژن و کانال مقعد – از نظر تاریخی پیشآگهی ضعیفی دارند. به دلیل کمبود نسبی آنها، کارآزماییهای بالینی کمی گزینههای درمانی را ارزیابی کردهاند. ما معمولاً رویکرد جراحی تهاجمی را برای بیمارانی که بیماری موضعی بالینی دارند توصیه نمیکنیم. به طور خاص، ما معمولاً برداشتن موضعی ملانومهای مقعد را به جای برداشتن ابدومینوپرینئال توصیه میکنیم. برداشتن ابدومینوپرینئال با عوارض بیشتری همراه است، بیمار را با کولوستومی دائمی مواجه میکند، هیچ مزیتی برای بقا ندارد و غدد لنفاوی کشاله ران در معرض خطر را درمان نمیکند، مگر اینکه این روش با تشریح کشاله ران ترکیب شود. پرتودرمانی کمکی ممکن است برای بیماران مبتلا به ملانوم مخاطی تجویز شود تا خطر عود موضعی-منطقهای کاهش یابد.
مدیریت بیماری منطقهای
غدد لنفاوی منطقهای شایعترین محل متاستاز ملانوما هستند. درگیری غدد لنفاوی به صورت بالینی مخفی یا بالینی تشخیص داده شده طبقهبندی میشود. تسکین مؤثر و گاهی اوقات درمان در بیماران مبتلا به متاستازهای منطقهای قابل دستیابی است. آسپیراسیون با سوزن ظریف یا بیوپسی هسته معمولاً میتواند در بیمارانی که غدد لنفاوی منطقهای بزرگ شده بالینی دارند، تشخیص را ایجاد کند. بیوپسی برشی یا اکسیزیونال به ندرت برای اهداف تشخیصی تجویز میشود.
دیدگاه تاریخی
مدیریت غدد لنفاوی منطقهای که از نظر بالینی مخفی هستند، مورد بحث طولانی و گاهی بحثبرانگیز بوده است. از نظر تاریخی، برخی از جراحان ترجیح میدادند که لنفادنکتومی را فقط برای متاستازهای گرهای که از نظر بالینی قابل اثبات بودند، انجام دهند. این نوع برداشت، تشریح تاخیری یا درمانی غدد لنفاوی (TLND) نامیده میشود. سایر جراحان
در بیمارانی که در معرض خطر بالای ابتلا به متاستازهای گرهای هستند، حتی زمانی که غدد طبیعی به نظر میرسیدند، آنها را برداشتند. این برداشت، تشریح فوری، پیشگیرانه یا انتخابی غدد لنفاوی (ELND) نامیده شده است. از دهه 1990، جراحان عموماً از یک رویکرد انتخابی برای تشریح غدد لنفاوی منطقهای استفاده کردهاند و از تکنیک نقشهبرداری لنفاوی حین عمل و شناسایی غدد لنفاوی نگهبان (SLN) که در ابتدا توسط مورتون و همکارانش برای بیمارانی با غدد لنفاوی منطقهای منفی از نظر بالینی که ملانوم اولیه دارند و خطر کافی برای داشتن متاستازهای مخفی غدد لنفاوی منطقهای دارند، استفاده کردهاند (به بخش نقشهبرداری لنفاوی حین عمل و بیوپسی غدد لنفاوی نگهبان مراجعه کنید).
با TLND، فقط بیمارانی که متاستازهای شناخته شده دارند، تحت لنفادنکتومی رسمی قرار میگیرند. این امر تعداد لنفادنکتومیهای بالقوه غیرضروری را کاهش میدهد. عیب TLND این است که به تأخیر انداختن درمان تا زمانی که متاستازهای غدد لنفاوی از نظر بالینی تشخیص داده شوند، ممکن است منجر به داشتن میکرومتاستازهای دوردست در زمان لنفادنکتومی توسط بیماران شود. بنابراین، احتمال افزایش بقا مرتبط با چنین رویکردی ممکن است کاهش یابد.
در مقابل، ELND از نظر تئوری این مزیت را داشت که متاستازهای غدد لنفاوی ملانوما را در مرحله نسبتاً اولیه در سیر طبیعی بیماری درمان کند. عیب ELND این است که اکثر بیمارانی که این روش به آنها پیشنهاد شده بود، متاستاز غدد لنفاوی نداشتند. طرفداران ELND استدلال میکردند که بیمارانی که غدد لنفاوی آنها از نظر بالینی منفی و از نظر بافتشناسی مثبت بود، در ELND شانس بیشتری برای بقا (50 تا 60 درصد) نسبت به بیمارانی داشتند که غدد لنفاوی منطقهای آنها تشریح نشده بود و متاستازهای بالینی آشکار در غدد لنفاوی منطقهای در طول پیگیری ایجاد شده بود (15 تا 35 درصد). هیچ یک از چهار مطالعه تصادفی و آیندهنگر که ELND را ارزیابی میکردند، مزیت بقای کلی را برای این تکنیک نشان ندادهاند.
دو کارآزمایی، یکی از WHO و دیگری از کلینیک مایو، در نهایت مورد انتقاد قرار گرفتند زیرا جمعیت مورد مطالعه آنها در معرض خطر کم بیماری غدد لنفاوی مخفی بودند و بنابراین بعید بود که بیماران از درمان جراحی پیشنهادی بهرهمند شوند.
اگرچه ELND برای همه بیماران مزیت بقا ارائه نکرد، دو کارآزمایی تصادفی آیندهنگر که بیماران با ریسک بالاتر و از نظر بالینی منفی را هدف قرار دادند، نشان دادند که ELND ممکن است در برخی از زیرگروههای بیمار، مزیت بقا داشته باشد. در کارآزمایی ELND سازمان بهداشت جهانی، بیماران مبتلا به ملانوم تنه با حداقل ضخامت ۱.۵ میلیمتر به صورت تصادفی به دو گروه برداشت گسترده و ELND در مقابل برداشت گسترده و تحت نظر قرار گرفتن تقسیم شدند.
نتایج بهروز شده از این کارآزمایی نشان داد که بیماران گروه درمان ELND که در ELND بیماری غدد لنفاوی میکروسکوپی داشتند، بقای کلی بهتری نسبت به بیمارانی داشتند که لنفادنوپاتی قابل لمس آنها پس از برداشتن گسترده تومور به تنهایی ایجاد شده بود. نتایج بلندمدت کارآزمایی بین گروهی ملانوم مشابه بود. در این کارآزمایی، بیماران مبتلا به ملانوم با ضخامت متوسط (1 تا 4 میلیمتر) که تحت برداشتن گسترده تومور و ELND قرار گرفتند، با گروه مشابهی از بیماران که تحت برداشتن گسترده تومور به تنهایی و به دنبال آن مشاهده حوضه غدد لنفاوی منطقهای قرار گرفتند، مقایسه شدند. اگرچه این کارآزمایی تفاوتی در میزان بقای کلی 10 ساله نشان نداد، اما چهار زیرگروه انتخابشده به صورت آیندهنگر، بقای 10 ساله به طور قابل توجهی بهتری با ELND نسبت به مشاهده غدد لنفاوی داشتند: بیمارانی که تومورهای اولیه آنها غیرزخمی بود (84٪ در مقابل 77٪، P = 0.03)؛ بیمارانی که ضخامت تومور اولیه آنها بین 1 میلیمتر و 2 میلیمتر (در مقابل ضخیمتر) بود (86٪ در مقابل 80٪، P = 0.03)؛ بیماران مبتلا به ملانوم اندام (در مقابل تنه) (84٪ در مقابل 78٪، P = 0.05)؛ و بیماران جوانتر از 60 سال (81٪ در مقابل 74٪، P = 0.03). نتایج یک کارآزمایی چند مرکزی از آلمان نیز مزیت مطلق بقا، حداقل 13٪، را برای بیمارانی که غدد لنفاوی مثبت آنها با بیوپسی غدد لنفاوی نگهبان (SLNB) در مقایسه با بیمارانی که غدد لنفاوی مثبت آنها در طول مشاهده حوضه غدد لنفاوی تشخیص داده شده بود، نشان داد. اگرچه این تجزیه و تحلیل گذشتهنگر بود، اما نتایج با یافتههای مطالعه WHO مطابقت داشت. در مجموع، این دادهها برخی از توصیههای تاریخی برای به تأخیر انداختن لنفادنکتومی تا زمان ایجاد بیماری غدد لنفاوی قابل لمس را زیر سوال برد. دادهها همچنین از استفاده از رویکردهای جایگزین برای امکان شناسایی زودتر بیماری غدد لنفاوی مخفی پشتیبانی کردند. اکنون یک رویکرد منطقیتر و انتخابیتر – نقشهبرداری لنفاوی و SLNB – به طور گسترده پذیرفته شده است. در مجموع، این تکنیک بسیاری از طرفداران ELND و TLND را راضی کرد.
نقشهبرداری لنفاوی حین عمل و بیوپسی غدد لنفاوی نگهبان
از دهه 1990، پس از معرفی آن توسط مورتون و همکارانش، چندین محقق، نقشهبرداری لنفاوی حین عمل و بیوپسی غدد لنفاوی نگهبان را به عنوان یک روش کم تهاجمی برای شناسایی تقریباً 15 تا 20 درصد از بیمارانی که این روش را دریافت میکردند و بیماری میکروسکوپی مخفی داشتند، پیشنهاد کردند. این رویکرد گاهی اوقات لنفادنکتومی انتخابی نامیده میشود. مطالعات متعددی نشان دادهاند که لنفادنکتومیهای لنفاوی نگهبان، در صورت وجود متاستاز، اولین غددی هستند که حاوی متاستاز میشوند و بنابراین وضعیت پاتولوژیک لنفادنکتومیهای لنفاوی نگهبان، وضعیت کل حوضه گرهای منطقهای را نشان میدهد. اگر لنفادنکتومی لنفاوی نگهبان فاقد متاستاز باشد، بعید است که بقیه غدد لنفاوی منطقهای حاوی بیماری باشند و نیازی به انجام لنفادنکتومی کامل نیست. مطالعات متعدد نشان دادهاند که میزان منفی کاذب فوری برای لنفادنکتومی لنفاوی نگهبان کمتر از 5 درصد است. مطالعات دیگر اعتبار مفهوم SLN و دقت SLNB را به عنوان یک روش مرحلهبندی تأیید کردهاند. با این حال، ضروری است که جراح استفاده کننده از SLNB، از پشتیبانی کافی پاتولوژی و پزشکی هستهای برخوردار باشد.
تکنیک بیوپسی غدد لنفاوی نگهبان
به شدت ترجیح داده میشود که نقشهبرداری لنفاوی و SLNB در زمان برداشتن گسترده ملانوم اولیه انجام شود. اگر قبلاً برداشتن گسترده انجام شده باشد، SLNB همچنان میتواند با دقت معادل انجام شود. با این حال، بازسازی گسترده قبلی محل برداشتن گسترده ملانوم اولیه (به عنوان مثال، با بازسازی فلپ چرخشی گسترده) که مسیرهای لنفاوی را در منطقه تغییر میدهد، اگر پس از برداشتن گسترده در چنین بیمارانی انجام شود، ممکن است دقت این تکنیک را به طور قابل توجهی کاهش دهد. از زمان معرفی نقشهبرداری لنفاوی و SLNB، این تکنیک دستخوش اصلاحات متعددی شده است که منجر به بهبود تشخیص SLNها شده است. استفاده از یک رنگ آبی حیاتی برای شناسایی SLNها از زمان معرفی آن بخشی از این تکنیک بوده است. ما معمولاً در موسسه خود از ایزوسولفان بلو ۱٪ یا لنفازورین استفاده میکنیم. اگر مشخص شود که بیماری سابقه قابل توجهی از واکنشهای آلرژیک دارد، ممکن است متیلن بلو را جایگزین کنیم و به طور غیرمستقیم نتایج کلی مشابه و عوارض جانبی مطلوب را گزارش کنیم.
رنگ آبی به صورت داخل پوستی در اطراف تومور سالم باقی مانده یا محل بیوپسی تزریق میشود. این رنگ توسط سیستم لنفاوی جذب شده و از طریق مجاری لنفاوی آوران به SLN(ها) منتقل میشود. حوضه غدد لنفاوی تخلیه کننده بررسی میشود و کانالهای لنفاوی آوران و اولین غدد لنفاوی تخلیه کننده (SLNها) با جذب رنگ آبی شناسایی میشوند. با استفاده از رنگ آبی به تنهایی، روشی که عمدتاً در اوایل دهه 1990 مورد استفاده قرار گرفت، تقریباً در 85٪ موارد SLN شناسایی شد. اگرچه این رویکرد اولیه امیدوارکننده بود، اما 15٪ از بیماران به دلیل عدم شناسایی SLN نتوانستند از این روش بهرهمند شوند. متعاقباً، تکنیکهای دیگری نیز به کار گرفته شدند که به طور قابل توجهی مکانیابی SLN را بهبود بخشیدند: (الف) لنفوسنتیگرافی قبل از عمل و (ب) تزریق داخل جلدی کلوئید گوگرد نشاندار شده با تکنسیوم-۹۹ (۹۹Tc) همراه با استفاده از یک گاما پروب دستی در حین عمل.
لنفوسنتیگرافی قبل از عمل با استفاده از تشخیص بیمارانی که چندین حوضه گرهای تخلیه دارند و بیمارانی که غدد لنفاوی آنها به SLN های واقع در خارج از حوضههای گرهای استاندارد، از جمله اپیتروکلر، پوپلیتئال و محلهای نابجا/فاصلهای/در حال عبور، تخلیه میشود (شکل 3.2). در بیماران مبتلا به ملانوما که به چندین حوضه گرهای منطقهای تخلیه میشوند، وضعیت بافتشناسی یک حوضه تخلیه، وضعیت سایر حوضهها را پیشبینی نمیکند. در یک مطالعه، از بین 54 بیماری که تحت SLNB از یک محل گرهای غیرمنتظره قرار گرفتند، 7 نفر (13٪) متاستاز غدد لنفاوی در آن محل داشتند. در چهار نفر از هفت بیمار، تنها SLN مثبت از محل غیرمعمول بود. بنابراین، شناسایی و ارزیابی همه حوضههای گرهای منطقهای در معرض خطر برای مرحلهبندی صحیح بیماری بسیار مهم است. یکی از پیشرفتهای تصویربرداری هستهای سنتی، استفاده از تصویربرداری توموگرافی کامپیوتری با انتشار تک فوتون (SPECT) است که با سیتی ادغام شده است. SPECT/CT با همپوشانی فعالیت جذب رادیودارو بر روی تصویر CT بدون ماده حاجب، مکانیابی SLNها را تسهیل میکند و بهویژه در ناحیه سر و گردن مفید است. در یک مطالعه، رویکرد جراحی بر اساس نتایج تصویربرداری SPECT/CT در حداکثر 30٪ موارد مورد تجدیدنظر قرار گرفت.
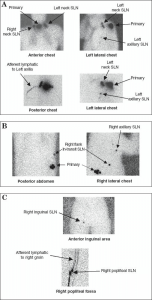 |
| شکل 3.2 لنفوسنتیگرافی قبل از عمل. پس از تزریق کلوئید گوگرد نشاندار شده با 99Tc در محل ملانوم پوستی اولیه (خط میانی فوقانی پشت)، لنفوسنتیگرافی قبل از عمل (الف) تخلیه به چندین حوضه غدد لنفاوی (گردن دو طرفه و زیر بغل چپ)، (ب) غدد لنفاوی نگهبان (SLN) “در حال عبور”/ نابجا در ناحیه پهلو راست و زیر بغل راست از یک تومور اولیه در قسمت جانبی راست پشت، و (ج) SLN ها در یک حوضه غدد لنفاوی حفره رکبی اندام تحتانی راست و یک حوضه غدد لنفاوی اینگوینال راست از یک تومور اولیه پاشنه پا را نشان داد. (عکسها از Gershenwald JE. حق چاپ متعلق به Gershenwald و مرکز سرطان MD Anderson دانشگاه تگزاس است.) |
شاید مهمترین پیشرفت در تکنیک SLNB، معرفی نقشهبرداری لنفاوی حین عمل با استفاده از یک پروب گامای دستی باشد. در این رویکرد، کلوئید گوگردی نشاندار شده با 99Tc با دوز 0.5 تا 1.0 میلیکوری قبل از جراحی، چه در پزشکی هستهای قبل از ورود به اتاق عمل و چه معمولاً پس از القای بیهوشی عمومی، به صورت داخل پوستی تزریق میشود. در طول جراحی، از یک پروب گامای دستی برای شناسایی SLNها از طریق پوست استفاده میشود تا حذف آنها تسهیل شود. استفاده از رنگ آبی و رادیوکلوئید، توانایی جراح را در شناسایی SLN (حساسیت بیش از 96 تا 99 درصد) در مقایسه با استفاده از رنگ آبی به تنهایی (حساسیت ≈84 درصد) افزایش میدهد. اگرچه اکثر پزشکان از یک رویکرد ترکیبی استفاده میکنند، برخی استراتژی تک عاملی کلوئید گوگردی نشاندار شده با 99Tc را به تنهایی ترجیح میدهند و برخی حساسیت بسیار خوبی را در مقایسه با استراتژی ترکیبی گزارش کردهاند. میزان بروز و پیشبینیکنندههای مثبت بودن غدد لنفاوی نگهبان
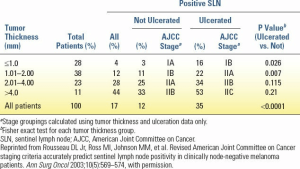
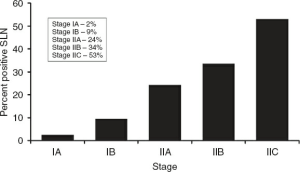
آگاهی از عوامل پیشبینیکننده مثبت بودن SLN برای مشاوره به بیماران در مورد گزینههای درمانی مفید است. در اکثر مطالعات، میزان کلی بروز مثبت بودن SLN در بین بیمارانی که تحت SLNB قرار میگیرند، از 15 تا 20 درصد متغیر است. تجزیه و تحلیلهای چند متغیره چندین عامل مرتبط با افزایش خطر مثبت بودن SLN را نشان دادهاند: افزایش ضخامت تومور، زخم شدن، میزان میتوز بالا، سن کم و محل تومور محوری، که عوامل غالب در اکثر مطالعات ضخامت تومور و زخم شدن آن بودهاند. در یک گزارش، میزان بروز مثبت بودن SLN در بین بیماران مبتلا به ملانوم 1 میلیمتر یا کمتر، 4 درصد و در بین بیماران مبتلا به ملانوم ضخیمتر از 4 میلیمتر، 44 درصد بود (جدول 3.6). در همان گزارش، بیماران مبتلا به تومورهای اولیه زخمی، میزان متاستاز SLN بالاتری نسبت به بیماران دارای ضایعات غیر زخمی داشتند (به ترتیب 35 درصد در مقابل 155 درصد). میزان بروز متاستازهای SLN بر اساس زیرمرحله بالینی AJCC از یک مطالعه نهادی در شکل 3.3 نشان داده شده است؛ میزان بروز SLN مثبت برای مراحل IA، IB، IIA، IIB و IIC به ترتیب 2٪، 9٪، 24٪، 34٪ و 53٪ بود.
| جدول 3.6میزان بیوپسی مثبت غده لنفاوی نگهبان، طبقهبندی شده بر اساس ضخامت تومور و زخم اولیه تومور (N = 1,375) |
 |
 |
|
شکل 3.3 میزان بروز غدد لنفاوی نگهبان مثبت (SLN) طبقهبندی شده بر اساس ضخامت تومور اولیه و زخم (n = 1,375). تفاوت بین هر مرحله از نظر آماری معنیدار است. نمودار داخل کادر، درصد بیماران با SLN مثبت را در هر دسته نشان میدهد. (بازنشر شده از Rousseau DL Jr, Ross MI, Johnson MM, et al. Revised از معیارهای مرحلهبندی کمیته مشترک آمریکا در مورد سرطان که به طور دقیق مثبت بودن غدد لنفاوی نگهبان را در بیماران مبتلا به ملانوم با غدد لنفاوی منفی بالینی پیشبینی میکند. Ann Surg Oncol 2003;10:569–574، با اجازه.) |
ارزش پیشآگهی وضعیت غدد لنفاوی نگهبان
اهمیت پیشآگهی وضعیت پاتولوژیک SLN به طور قانعکنندهای نشان داده شده است. دادههای مرکز سرطان MD Anderson دانشگاه تگزاس نشان داد که وضعیت SLN مهمترین عامل پیشآگهی بالینی-پاتولوژیک در رابطه با بقا در بیماران مبتلا به ملانوما است. در تجزیه و تحلیل 1487 بیمار که تحت SLNB قرار گرفتند (ضخامت متوسط تومور، 1.5 میلیمتر)، میزان بقای 5 ساله برای بیماران با SLN مثبت 73.3٪ بود، در حالی که این میزان برای بیماران با SLN منفی 96.8٪ بود (شکل 3.4). چندین تجزیه و تحلیل رگرسیون چند متغیره دیگر نشان دادهاند که وضعیت غدد لنفاوی منطقهای، حتی در میان بیماران مبتلا به ملانومهای ضخیم، قویترین پیشبینیکننده عود (هم منطقهای و هم دوردست) و بقا است. طبق تحلیل پایگاه داده AJCC نسخه هفتم، میزان بقای ۵ ساله برای بیماران مبتلا به بیماری مرحله III، در کنار بیمارانی که بیماری منطقهای بالینی دارند، از ۸۱٪ برای بیمارانی که فقط یک غده لنفاوی مثبت از نظر میکروسکوپی و یک ملانوم اولیه غیرزخمی دارند تا ۲۹٪ برای بیمارانی که بیماری غدد لنفاوی بالینی آشکار با بیش از سه غده لنفاوی درگیر از نظر پاتولوژیک دارند، متغیر است.
اهمیت پیشآگهی تمایز بین غدد لنفاوی مخفی بالینی و غدد لنفاوی تشخیص داده شده بالینی با گنجاندن این معیار در سیستم مرحلهبندی ملانوم AJCC مورد تأکید قرار گرفته است. مفهوم بار تومور در دوران SLNB اهمیت پیدا کرده است، زیرا مرحلهبندی دقیق میکروسکوپی SLNها به بیماران اجازه میدهد تا بهتر در زیرگروههای خطر مشابه طبقهبندی شوند. مطالعات متعددی نشان دادهاند که قطر بزرگترین گره تومور SLN و حجم کل تومور SLN پیشبینیکنندههای مهمی برای عود و بقا هستند. در یک مطالعه روی ۳۸۱ بیمار، فرانسیسچتو و همکارانش… دریافتند که در میان بیمارانی که متاستاز SLN ≤0.2 میلیمتر داشتند، بقای بدون عود و پیشآگهی کلی مشابه بیماران با SLN منفی بود. اهمیت پیشآگهی بار تومور غده لنفاوی نگهبان همچنان یک حوزه فعال تحقیقاتی در سراسر جهان است.
آزمایش لنفادنکتومی انتخابی چند مرکزی آیندهنگر برجسته-I (MSLT-1) در سال 1994 طراحی شد تا ارزیابی کند که آیا رویکرد انتخابی به لنفادنکتومی منطقهای – محدود کردن تشریح کامل غدد لنفاوی به بیماران مبتلا به بیماری میکروسکوپی در SLNها – در مقایسه با برداشتن گسترده ملانوم اولیه و مشاهده حوضه غدد لنفاوی منطقهای، مزیت بقا را به همراه دارد یا خیر. بیماران مبتلا به ملانومهای پوستی اولیه با حداقل 1 میلیمتر ضخامت یا تومورهای سطح چهارم یا پنجم کلارک با هر ضخامت برسلو واجد شرایط این آزمایش بودند. دو هزار و یک بیمار به طور تصادفی به دو گروه تقسیم شدند: گروه اول فقط برداشتن گسترده غدد لنفاوی و مشاهده حوضه(های) لنفاوی منطقهای (40%) و گروه دوم برداشتن گسترده غدد لنفاوی و نقشهبرداری لنفاوی و لنفادنکتومی کامل در صورت مثبت بودن SLNها.
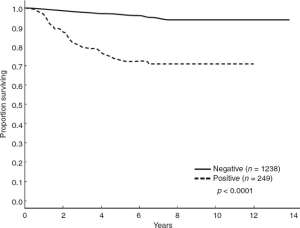 |
| شکل 3.4 بقای اختصاصی بیماری بر اساس وضعیت غدد لنفاوی نگهبان (SLN) در 1487 بیمار. وضعیت SLN مهمترین عامل پیش آگهی بالینی-پاتولوژیک در رابطه با بقا بود. میزان بقای 5 ساله اختصاصی بیماری برای بیماران با SLN مثبت 73.3٪ بود، در حالی که برای بیماران با SLN منفی 96.8٪ بود. |
در سال ۲۰۱۴، گزارش نهایی آزمایش با ۱۰ سال پیگیری منتشر شد. ۱۵۸ داده. میزان بقای ده ساله بدون بیماری در گروه SLNB به طور قابل توجهی بالاتر از گروه مشاهده در میان بیماران مبتلا به ملانوم با ضخامت متوسط بود: ۷۱.۳ ± ۱.۸٪ در گروه SLNB در مقایسه با ۶۴.۷ ± ۲.۳٪ در گروه مشاهده (نسبت خطر برای عود یا متاستاز، ۰.۷۶؛ ۹۵٪ CI ۰.۶۲ تا ۰.۹۴؛ P = ۰.۰۱). هنگامی که گروه SLNB بیشتر بررسی شد، مشخص شد بیمارانی که شواهدی از درگیری میکروسکوپی SLN داشتند، نسبت به بیمارانی که SLNB منفی داشتند، وضعیت بدتری داشتند. برای بیماران مبتلا به ملانوم اولیه با ضخامت متوسط (که در MSLT-I به عنوان ۱.۲ تا ۳.۵ میلیمتر تعریف شده است)، بقای اختصاصی ملانوما در ۱۰ سال در بیمارانی که SLNB مثبت داشتند در مقایسه با بیمارانی که SLNB منفی داشتند، به طور قابل توجهی بدتر بود (۶۲٪ در مقابل ۸۵٪، HR۳.۰۹، ۹۵٪ CI ۲.۱۲ تا ۴.۴۹). برای بیماران مبتلا به ملانوم ضخیم (که در MSLT-I به عنوان >۳.۵۰ میلیمتر تعریف شده است)، میزان بقای اختصاصی ملانوما در ۱۰ سال دوباره در بیمارانی که درگیری غدد لنفاوی داشتند در مقایسه با بیمارانی که بیوپسی غدد لنفاوی منفی داشتند، به طور قابل توجهی بدتر بود (۴۸.۰٪ در مقابل ۶۴.۶٪، HR۱.۷۵، ۹۵٪ CI ۱.۰۷ تا ۲.۸۷). این کارآزمایی ارتباطی بین بیماران مبتلا به ملانومهای نازک شناسایی نکرد، اما اشاره کرد که تعداد رویدادهای آن برای تجزیه و تحلیل بسیار کم است. نتایج MSLT-1 توسط یک تحلیل بزرگتر، هرچند گذشتهنگر، در یک موسسه واحد توسط موسسه ملانومای استرالیا (MIA) در یک دوره 16 ساله قبل از سال 2008 تأیید شد. آنها بیمارانی را که فقط تحت عمل جراحی برداشتن گسترده (N = 2931) در مقابل برداشتن همراه با SLNB (N = 2909) قرار گرفتند، شناسایی کردند. تجزیه و تحلیل تک متغیره طبقهبندی شده برای زیرگروههای مختلف، بقای اختصاصی ملانوما را برای بیماران SLNB با ضایعات با ضخامت >1 میلیمتر تا 4 میلیمتر (P = 0.011) به طور قابل توجهی بهتر نشان داد و بقای بدون بیماری و بدون عود در گروه SLNB در مقایسه با گروه مشاهده (هر دو P < 0.001) بهبود یافت، و نتیجه گیری شد که نتیجه برای بیمارانی که تحت SLNB قرار گرفتند، بهتر بود.
ارزیابی پاتولوژیک غدد لنفاوی نگهبان
پاتولوژیستها به طور سنتی غدد لنفاوی به دست آمده از لنفادنکتومی را با بررسی یک بخش رنگآمیزی شده با هماتوکسیلین-ائوزین از هر بلوک پارافین بررسی کردهاند. با این حال، این رویکرد مرسوم، میتواند بیماری را در SLNها نادیده بگیرد، که عمدتاً به دلیل خطای نمونهگیری است. در یک مطالعه، از هر 10 بیماری که تحت SLNB قرار گرفتند و متعاقباً دچار نارسایی منطقهای گره در حوضههای گرهای شدند که طبق بررسی بافتشناسی مرسوم SLNها از نظر بیماری منفی بودند، بیماری میکروسکوپی در 8 بیمار تشخیص داده شد، زمانی که SLNها با استفاده از تکنیکهای تخصصی پاتولوژیک مجدداً ارزیابی شدند. دادههای حاصل از این مطالعه و سایر مطالعات نشان میدهد که عدم استفاده از تکنیکهای تخصصی، به جای عدم شناسایی صحیح SLNها، دلیل بسیاری از موارد یافتههای منفی کاذب در SLNB است. این مطالعات به تعریف استانداردهای فعلی ارزیابی SLN با استفاده از ارزیابی پاتولوژیک پیشرفتهتر از آنچه قبلاً انجام شده بود، کمک کردند.
با تکنیک SLNB، تعداد کمتری از گرههای لنفاوی برای تجزیه و تحلیل نسبت به لنفادنکتومی رسمی ارسال میشوند و بنابراین پاتولوژیست میتواند فقط روی آن گرهها – SLNها – که در معرض بیشترین خطر هستند تمرکز کند. در حال حاضر، ترکیبی از ارزیابی هماتوکسیلین-ائوزین در سطوح مختلف و تجزیه و تحلیل ایمونوهیستوشیمی به طور کلی یک روش استاندارد در ارزیابی SLNها محسوب میشود. چندین آنتیبادی علیه آنتیژنهای مرتبط با ملانوما (S-100، HMB-45، تیروزیناز، MAGE3 و MART-1) به طور معمول برای ارزیابی ایمونوهیستوشیمی استفاده میشوند. از آنجا که برخی از آنتیبادیها اختصاصیت پایینی دارند (S-100) و برخی دیگر حساسیت پایینی دارند (HMB-45، MAGE3 و تیروزیناز)، معمولاً از یک پنل آنتیبادی استفاده میشود. در مرکز سرطان MD Anderson، این پنل شامل HMB-45 و MART-1 است.
استفاده از برش منجمد برای ارزیابی فوری SLNها در ملانوما بسیار بحثبرانگیز است. برشهای منجمد معمولاً مورفولوژی غیربهینه ارائه میدهند و ممکن است فاقد ناحیه زیر کپسولی غدد لنفاوی (ناحیهای که احتمالاً در متاستازهای SLN دخیل است) باشند. همچنین، پردازش بافت منجمد نیاز به برش اضافی دارد و ممکن است میکرومتاستازها در بخشهای بررسی نشده دور ریخته شده از بین بروند. بنابراین، برای SLN های بیماران مبتلا به ملانوما، اکثر پروتکلها بررسی مواد فرآوری شده معمول (فیکس شده با فرمالین، جاسازی شده در پارافین) را به عنوان استاندارد طلایی در نظر میگیرند. یک جایگزین احتمالی، آمادهسازی لمسی/آنالیز سیتولوژیک نمونهها است؛ به نظر میرسد این رویکردها ارزیابی SLN دقیق و مقرون به صرفهای را در برخی از مراکز تخصصی ارائه میدهند. ما قویاً احساس میکنیم که استفاده از برش منجمد، خطر دقت کمتر در تشخیص ضایعات متاستاتیک را به همراه دارد.
به طور کلی، این رویکرد فقط در صورتی استفاده میشود که SLN به شدت مشکوک شناسایی شود و اگر بحث رسمی قبل از عمل در مورد احتمال لنفادنکتومی تکمیل همزمان انجام شده باشد. از آنجا که حتی ترکیب بررسی بافتشناسی و ایمونوهیستوشیمی SLN ها ممکن است در شناسایی سلولهای جدا شده ملانوم یا رسوبات الیگوسلولی ناموفق باشد، برخی رویکردی مبتنی بر مولکولی را برای بررسی SLN ها پیشنهاد کردهاند.
با استفاده از واکنش زنجیرهای پلیمراز-ترانس کریپتاز معکوس (RT-PCR)، تخمین زده شده است که میتوان یک سلول ملانوما را در پسزمینهای از 1 × 106 تا 1 × 107 سلول طبیعی شناسایی کرد. با این حال، برخی از محققان پیشنهاد کردهاند که این سطح از حساسیت تشخیصی ممکن است در واقع بیماری مرتبط با بالینی را بیش از حد تخمین بزند. برخی مطالعات نشان میدهد که پیشآگهی بیماران مبتلا به SLN که با RT-PCR مثبت اما با آنالیز بافتشناسی یا ایمونوهیستوشیمی منفی هستند، بدتر از بیمارانی است که SLNهای آنها با هر دو تکنیک منفی است.
اگرچه نتایج اولیه جالب توجه بود، اما اهمیت بالینی یافتههای مثبت RT-PCR در SLN منفی از نظر بافتشناسی به نقاط پایانی مرتبط بالینی با پیگیریهای بیشتر تبدیل نشده است.
بنابراین، این یا سایر رویکردهایی که سعی در بررسی SLNها در سطح “مولکولی” دارند، در حال حاضر خارج از عرصه تحقیق یا کارآزمایی بالینی توصیه نمیشوند، زیرا نقش مرحلهبندی مولکولی در بیمارانی که تحت نقشهبرداری لنفاوی و SLNB قرار میگیرند، هنوز در حال ارزیابی است.
شناسایی بیماری اضافی در غدد لنفاوی غیر سنتینل
به طور کلاسیک، بیمارانی که SLN مثبت ملانوما دارند و توسط SLNB شناسایی شدهاند، لنفادنکتومی تکمیلی انجام دادهاند. ارزیابی پاتولوژیک نمونههای لنفادنکتومی تکمیلی اغلب هیچ بیماری اضافی را نشان نمیدهد. مهم است به یاد داشته باشید که نمونههای لنفادنکتومی تکمیلی به طور معمول با تکنیکهای بافتشناسی استاندارد ارزیابی میشوند، نه با رویکرد دقیقتری که برای نمونههای SLNB به کار میرود. در نتیجه، ممکن است در واقع بیماری اضافی در نمونه تشریح غدد لنفاوی تکمیلی وجود داشته باشد که تشخیص داده نشود. این بیماری، از نظر تئوری، منبع بالقوه عود بعدی در صورت عدم برداشت است. از آنجا که درمان چنین عودهایی از نظر جراحی دشوار است و ممکن است به عوارض قابل توجهی منجر شود، لنفادنکتومی تکمیلی که برای بیماری میکروسکوپی انجام میشود، امکان کنترل منطقهای بهبود یافته را فراهم میکند. علاوه بر این، شناسایی بیماران با حداقل بار بیماری با استفاده از رویکرد SLN ممکن است به شناسایی گروهی از بیماران کمک کند که ممکن است از TLND زودهنگام (یعنی لنفادنکتومی تکمیلی) سود بقای بهتری کسب کنند. علاوه بر این، آگاهی از وضعیت پاتولوژیک SLNها امکان مرحلهبندی مناسب را فراهم میکند و بنابراین تصمیمگیری در مورد درمان کمکی را تسهیل میکند. در چندین مطالعه، هنگامی که nonSLNها در یک نمونه لنفادنکتومی تکمیلشده با رنگآمیزی هماتوکسیلین-ائوزین و ایمونوهیستوشیمی ارزیابی شدند، تنها 8 تا 25 درصد از نمونههای لنفادنکتومی تکمیلشده حاوی غدد لنفاوی اضافی با بیماری متاستاتیک بودند. از آنجایی که اکثر بیماران بیماری متاستاتیک دارند که فقط در SLNها شناسایی میشود، علاقه به شناسایی بیمارانی وجود داشته است که علیرغم داشتن SLN مثبت، احتمال کمی برای بیماری متاستاتیک در غیر SLNها دارند.
در تجزیه و تحلیل ویژگیهای تومور اولیه و SLN، تعداد SLNهای برداشتشده، ضخامت برسلو تومور اولیه و بار SLN (بزرگترین کانون متاستاز، مساحت کل متاستازها، تعداد کانونهای متاستاتیک و گسترش خارج کپسولی) با دقت بیشتری وجود تومور را در غیر SLNها پیشبینی کردند. اگرچه این نتایج جذاب هستند و نیاز به مطالعه بیشتر دارند، اما هنوز نمیتوان تصمیمات مربوط به لنفادنکتومی کامل را صرفاً بر اساس ویژگیهای تومور اولیه یا SLN اتخاذ کرد. لنفادنکتومی کامل پس از شناسایی SLN مثبت، بیش از دو دهه است که به عنوان یک استاندارد مراقبتی مطرح بوده است، اگرچه فقدان یک مزیت بقاء تعریفشده که به طور خاص با تشریح کامل غدد لنفاوی در میان بیماران با SLN مثبت مرتبط باشد، به آغاز دورهای از کارآزماییهای بالینی که برای ارزیابی این سوال بالینی مهم طراحی شدهاند، کمک کرده است.
آزمایش لنفادنکتومی انتخابی چند مرکزی-II (MSLT-II) به دنبال پاسخ به این سوال با تصادفیسازی بیماران با حداقل یک SLN مثبت به مشاهده غدد لنفاوی یا لنفادنکتومی کامل فوری پس از SLN مثبت است. نقاط پایانی مبتنی بر جمعبندی تکمیلشده کارآزمایی (N > 1900) و بقاء اخیراً گزارش شدهاند. به طور کلی، در یک پیگیری متوسط 43 ماهه، در تجزیه و تحلیل هر پروتکل، میانگین بقای اختصاصی ملانوما 3 ساله (نقطه پایانی اولیه) در هر دو گروه تشریح و گروه مشاهده مشابه بود. کنترل بیماری در غدد لنفاوی منطقهای در ۳ سال نیز در گروه تشریح در مقایسه با گروه مشاهده افزایش یافته بود (۹۲٪ در مقابل ۷۷٪؛ P < ۰.۰۰۱). متاستازهای غدد لنفاوی غیر سنتینل (که در ۱۱.۵٪ از بیماران گروه تشریح شناسایی شدند) یک پیشبینیکننده قوی و مستقل برای عود بودند (نسبت خطر، ۱.۷۸؛ P = ۰.۰۰۵). روی هم رفته، این دادههای اولیه از این پشتیبانی میکنند که CLND فوری کنترل بیماری منطقهای را افزایش داده و اطلاعات پیشآگهی ارائه میدهد، اما MSS را در این بیماران با متاستازهای SLN افزایش نمیدهد. در کارآزمایی بالینی فاز III DeCOG-SLT چند مرکزی آلمانی، ۴۸۳ بیمار با SLNB مثبت به طور تصادفی به جراحی فوری (یعنی لنفادنکتومی کامل پس از SLNB مثبت) یا مشاهده غدد لنفاوی منطقهای اختصاص داده شدند.
نکته قابل توجه این است که ۶۶٪ از بیماران متاستاز SLN به اندازه ۱ میلیمتر یا کمتر داشتند. در پیگیری متوسط ۳۵ ماهه، در میان ۴۷۳ نفری که در تجزیه و تحلیل قصد درمان گنجانده شده بودند، نویسندگان دریافتند که تفاوت معنیداری در نقطه پایانی اولیه بقای ۳ ساله بدون متاستاز دوردست وجود ندارد: ۷۷٪ در مقابل ۷۵٪ برای گروههای مشاهده در مقابل تشریح کامل فوری (HR ۱.۰۳، ۹۵٪ CI ۰.۷۰ تا ۱.۵۰). با این حال، آنها تفاوت معنیداری را در میزان عود منطقهای در بین گروهها گزارش کردند. تجزیه و تحلیل در حال انجام است. به نظر میرسد که بیماران در گروه جراحی فوری، کنترل بیماری موضعی-منطقهای بهتری داشتند و پیگیری مداوم برای تشخیص بیشتر این نقاط پایانی مبتنی بر بقای نسبتاً زودهنگام مهم خواهد بود. نکته مهم این است که باید توجه داشت که این مطالعه تحت تأثیر چالشهای ثبتنام قرار گرفته و به هدف خود که ۵۵۶ بیمار بود، دست نیافته است، بنابراین قدرت مطالعه را همانطور که در ابتدا گزارش شده بود، کاهش میدهد (تجزیه و تحلیل ITT، N = ۴۷۳).
دستورالعملهای عملی فعلی برای استفاده از بیوپسی غدد لنفاوی نگهبان
کاندیداهای بیوپسی غدد لنفاوی نگهبان شامل بیمارانی هستند که به تازگی ملانوم پوستی اولیه با علائم بالینی منفی از نظر غدد لنفاوی تشخیص داده شدهاند و بر اساس ویژگیهای تومور اولیه، پیشبینی میشود که در معرض خطر متوسط یا بالای ابتلا به بیماری غدد لنفاوی منطقهای مخفی باشند. اگرچه آستانههای خطر یکسان به طور کامل مشخص نشدهاند، اما آستانه ضخامت تومور حداقل ۱ میلیمتر به طور گسترده پذیرفته شده است. در حالی که استفاده روتین از بیوپسی غدد لنفاوی نگهبان در بیماران مبتلا به ملانوم نازک (<1 میلیمتر) به دلیل خطر کلی پایین درگیری غدد لنفاوی در این گروه توصیه نمیشود، رویکرد انتخابی به بیوپسی غدد لنفاوی نگهبان برای بیماران مبتلا به ملانوم نازک در بسیاری از مراکز بر اساس وجود عوامل خطر نامطلوب ثابت شده یا فرضی ملانوم اولیه تکامل یافته است و همچنان زمینهای برای بررسی و بحث مداوم است. بسیاری از پزشکان ملانوما آستانه خطر تقریباً ۵٪ را در یک فرد سالم برای ارائه نقشهبرداری لنفاوی و بیوپسی غدد لنفاوی نگهبان کافی میدانند و این به طور کلی شامل بیمارانی میشود که ضخامت تومور اولیه آنها >۰.۷۵ میلیمتر است. بنابراین، بر اساس جدیدترین دستورالعملهای AJCC (ویرایش هشتم)، بیماران مبتلا به ملانوم T1b (جدول 3.1) یا بالاتر میتوانند برای SLNB در نظر گرفته شوند. اگرچه بحث مفصل فراتر از محدوده این فصل است، اما یک منبع اطلاعاتی مفید برای این سوال بالینی مهم که عموماً منعکس کننده بحثهای جاری نیز هست، در دستورالعملهای NCCN، یک منبع آنلاین که معمولاً حداقل سالانه بهروزرسانی میشود، یافت میشود. لازم به ذکر است که وجود لنفادنوپاتی بالینی آشکار در زمان تشخیص، نیاز به SLNB را برطرف میکند، زیرا به این بیماران معمولاً در صورت عدم وجود متاستاز دوردست همزمان، TLND پیشنهاد میشود. هنگامی که SLNها منفی هستند، هیچ جراحی غدد لنفاوی منطقهای دیگری انجام نمیشود و غدد لنفاوی منطقهای باقی مانده دست نخورده باقی میمانند. هنگامی که SLNها شواهدی از بیماری متاستاتیک نشان میدهند، لنفادنکتومی کامل حوضه غدد لنفاوی آسیب دیده، یک استاندارد مراقبتی دیرینه بوده است. با این حال، این رویکرد توسط برخی افراد به دلیل فقدان کلی مزیت بقا در MSLT-1، یافتههای اولیه گزارش شده توسط کارآزمایی بالینی DeCOG که هیچ مزیت بقا برای CLND در پیگیری متوسط کمی کمتر از 3 سال نشان نداد، و نتایج اخیراً گزارش شده از MSLT-2 که همچنین هیچ مزیت بقا کلی برای CLND نشان نداد، مورد سوال قرار گرفته است. این بحث مداوم احتمالاً با گزارش دادههای کارآزماییهای بالینی، از جمله MSLT-II، مطالعات کامل و اضافی، ادامه خواهد یافت.
مدیریت بیماری غدد لنفاوی قابل تشخیص بالینی در زمان مراجعه
برای بیمارانی که با بیماری آشکار یا قابل تشخیص بالینی در حوضه غدد لنفاوی منطقهای مراجعه میکنند، بررسی مرحلهبندی توصیه میشود. معاینه فیزیکی باید برای شناسایی ضایعات مشکوک به ملانوم اولیه اضافی و همچنین شناسایی بیماری ماهوارهای و/یا متاستازهای در حال انتقال انجام شود. همچنین باید معاینه کامل غدد لنفاوی برای رد بیماری غدد لنفاوی مشکوک بالینی در سایر حوضههای منطقهای انجام شود. ارزیابی مرحلهبندی معمولاً شامل تصویربرداری پایه با اشعه ایکس قفسه سینه، اسکن توموگرافی کامپیوتری، PET/CT و/یا MRI مغز است. این رویکرد به جراح اجازه میدهد تا هرگونه بیماری منتشر شده بیشتر فراتر از حوضه منطقهای را که ممکن است مانع توصیه به لنفادنکتومی شود، شناسایی کند. اگر در زمان ارجاع، غدد لنفاوی از قبل برداشته نشده باشند، بیوپسی هدایت شده با تصویر (معمولاً با بیوپسی آسپیراسیون با سوزن ظریف) برای تأیید بیماری منطقهای بر برداشتن غدد لنفاوی ترجیح داده میشود. از رویکرد مشابهی میتوان برای مستندسازی سایر الگوهای متاستاز، مانند بیماری دوردست، که برنامهریزی درمان را تغییر میدهد، استفاده کرد. در غیاب متاستاز دوردست، بیماری غدد لنفاوی منطقهای عموماً با توصیهای برای لنفادنکتومی درمانی رسمی و به دنبال آن در نظر گرفتن درمان کمکی درمان شده است. با توجه به خطر بالای عود برای چنین بیمارانی، گروه ما، و همچنین دیگران، شروع به بررسی مفهوم درمان نئوادجوانت برای بیمارانی که با لنفادنوپاتی منطقهای بالینی مراجعه میکنند، کردهاند. به عنوان مثال، تلاشهای اخیر گروه ما بر پروفایل مولکولی اولیه این بیماران متمرکز بوده است. برای بیماران جهش یافته BRAF V600، ما اخیراً یک کارآزمایی کوچک اثبات مفهوم فاز II تصادفی درمان نئوادجوانت را با دابرافنیب + ترامتینیب قبل از جراحی (یک درمان ترکیبی که در حال حاضر برای بیماری غیرقابل جراحی یا متاستاتیک تأیید شده است؛ به بخش درمان هدفمند در زیر مراجعه کنید) و به دنبال آن جراحی در مقابل جراحی به تنهایی در بیماران مبتلا به بیماری مرحله IIIB/C قابل جراحی تکمیل کردیم. مهمتر از همه، ما در 58٪ از بیماران تحت درمان با گروه نئوادجوانت، پاسخ کامل پاتولوژیک (pCR) را مشاهده کردیم. تجزیه و تحلیل مداوم مشخص خواهد کرد که آیا pCR مزیت بقا را به همراه دارد و آیا این رژیم باید بیشتر بررسی شود.
ملاحظات فنی
تشریح زیر بغل
کلیات. تشریح زیر بغل شامل غدد لنفاوی سطوح I، II و III است (شکل 3.5). بازو، شانه و قفسه سینه آماده شده و در فیلد جراحی قرار میگیرند.
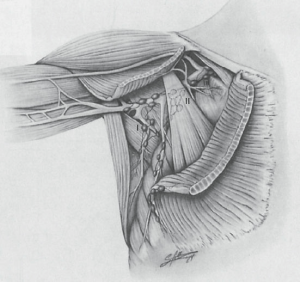 |
| شکل ۳.۵ آناتومی لنفاوی زیر بغل که سه گروه از غدد لنفاوی زیر بغل را نشان میدهد که بر اساس ارتباط آنها با عضله پکتورالیس مینور تعریف شدهاند. بالاترین غدد زیر بغل (سطح III) که در قسمت میانی عضله پکتورالیس مینور قرار دارند، باید در تشریح غدد لنفاوی زیر بغل برای ملانوم گنجانده شوند. (از Balch CM، Milton GW، Shaw HM و همکاران، ویرایش شده توسط. ملانوم پوستی. فیلادلفیا، پنسیلوانیا: Lippincott؛ ۱۹۸۵، با اجازه.) |
برش. ما معمولاً از یک برش کمی S شکل استفاده میکنیم که از جلو در امتداد قسمت فوقانی لبه جانبی عضله پکتورالیس ماژور شروع میشود، از زیر بغل روی دنده چهارم عبور میکند و به سمت پایین در امتداد لبه قدامی عضله لاتیسموس دورسی امتداد مییابد. برش باید طوری ساخته شود که جای زخمهای قبلی بتوانند به صورت یکپارچه با نمونه برداشته شوند.
فلپهای پوستی. فلپهای پوستی از جلو به لبه جانبی عضله پکتورالیس و خط میانی ترقوه، از پایین به دنده ششم، از عقب به لبه قدامی عضله لاتیسموس دورسی و از بالا درست زیر محل اتصال عضله پکتورالیس ماژور بالا آورده میشوند. سمت داخلی عضله لاتیسموس دورسی از نمونه جدا میشود و عروق و عصب توراکودورسال در معرض دید قرار میگیرند. لبه جانبی برش سپس به سمت سر تا ورید زیر بغل امتداد مییابد. در یک روش جانبی به داخلی، دسته عصبی-عروقی قفسه سینهای-پشتی اسکلتبندی شده و حفظ میشود. این مانورها عموماً اجازه میدهند که بخش بعدی تشریح از داخلی به خارجی ادامه یابد. بافت چربی و لنفاوی مجاور عضله سینهای بزرگ به صورت آزاد در اطراف سطح زیرین آن، جایی که عضله سینهای کوچک دیده میشود، تشریح میشود. شیار بین سینهای نمایان میشود.
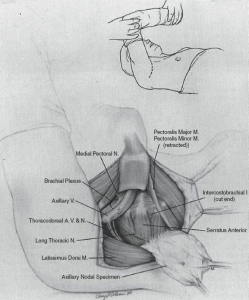 |
| شکل ۳.۶ دسترسی به زیر بغل فوقانی. بازو به گونهای پوشانده شده است که بتوان آن را در حین عمل روی دیواره قفسه سینه آورد. این کار باعث میشود عضلات پکتورالیس به سمت بالا جمع شوند تا غدد لنفاوی زیر بغل سطح III آشکار شوند. (از Balch CM، Milton GW، Shaw HM و همکاران، ویرایش شده توسط. پوست ملانوم. فیلادلفیا، پنسیلوانیا: Lippincott؛ ۱۹۸۵، با اجازه.) |
تشریح غدد لنفاوی. عصب سینهای داخلی حفظ میشود. غدد لنفاوی بین سینهای به صورت آزاد تشریح شده و بافت لنفاوی آرئولار از فضای روتر خارج میشود. در این مرحله، تشریح عموماً به صورت جانبی به داخلی انجام میشود، به طوری که بافت حاوی غدد لنفاوی به صورت داخلی برداشته میشود؛ دسته توراکودورسال دوباره مشاهده میشود و عصب سینهای بلند شناسایی و حفظ میشود. بافت چربی بین دو عصب از عضله ساباسکاپولاریس جدا شده و به نمونه اضافه میشود.
با نزدیک کردن و چرخش داخلی دست بیمار به قفسه سینه، زیر بغل فوقانی نمایان میشود. اگر غدد لنفاوی حجیم باشند، عضله پکتورالیس مینور ممکن است برای تسهیل در معرض دید قرار گرفتن، تقسیم شود. تشریح غدد لنفاوی زیر بغل فوقانی باید به اندازهای کامل باشد که خروجی قفسه سینه در زیر ترقوه، رباط هالستد و عضله سابکلاویوس دیده شود (شکل 3.6). بافتهای چربی و لنفاوی به سمت پایین و روی ورید زیر بغل تشریح میشوند. نوک نمونه تشریح شده ممکن است علامتگذاری شود. نمونه از دیواره جانبی قفسه سینه برداشته میشود. اعصاب بین دندهای-بازویی که از نمونه عبور میکنند، آسیب میبینند.
بستن زخم. یک کاتتر ساکشن بسته ۱۵ F معمولاً از طریق پوست از طریق فلپ تحتانی به زیر بغل وارد میشود. بسته به وضعیت بدن، ممکن است یک کاتتر اضافی از طریق فلپ تحتانی وارد شود. پوست با بخیههای قابل جذب رنگ نشده ۳-۰ منقطع و بخیههای قابل جذب زیر جلدی ۴-۰ بسته میشود.
مدیریت پس از عمل. تخلیه ساکشن عموماً تا زمانی که میزان خروجی کمتر از ۳۰ میلیلیتر در روز به مدت ۲ روز متوالی باشد، ادامه مییابد. تقریباً تا ۴ هفته، کاتترهای ساکشن، صرف نظر از میزان تخلیه، برداشته میشوند تا احتمال عفونت کاهش یابد. تجمعات بعدی مایعات با آسپیراسیون سوزنی یا گاهی اوقات با تخلیه از راه پوست خارج میشوند.
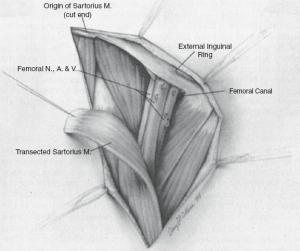
تشریح سطحی کشاله ران
کلیات. برای تشریح کشاله ران، بیمار در وضعیت پای قورباغهای قرار میگیرد، به طوری که ران به سمت خارج چرخیده و زانو تا حدی خم شده باشد.
برش. یک برش S شکل از قسمت فوقانی داخلی تا خار خاصره قدامی فوقانی، به صورت عمودی تا چین اینگوینال، به صورت مورب در سراسر چین و سپس به صورت عمودی تا رأس مثلث فمورال ایجاد میشود. برشهای قبلی SLNB و حفرههای زیرین باید به صورت یکپارچه با نمونه برداشته شوند.
فلپهای پوستی. محدوده فلپهای پوستی از سمت داخلی تا برجستگی شرمگاهی و قسمت میانی عضله نزدیککننده بزرگ، از سمت خارجی تا لبه جانبی عضله سارتوریوس، از سمت بالا تا تقریباً 5 سانتیمتر بالای رباط اینگوینال و از سمت تحتانی تا رأس مثلث فمورال است.
تشریح غدد لنفاوی. تشریح تا فاسیای عضلانی در بالا انجام میشود (شکل 3.7). تمام بافت چربی حاوی گره به سمت پایین و رباط اینگوینال و از فاسیای مایل خارجی کشیده میشود. در قسمت میانی، طناب اسپرماتیک یا رباط گرد نمایان میشود و بافت گره به سمت جانبی کشیده میشود. بافت گره از فاسیای ادکتور به سمت ورید فمورال کشیده میشود. در راس مثلث فمورال، ورید صافن شناسایی میشود. اگر ورید صافن قابل حفظ باشد، بافت گره به صورت محیطی از رگ خارج میشود: در غیر این صورت، قربانی میشود. در قسمت جانبی، بافت گره از عضله سارتوریوس و عصب فمورال جدا میشود. با تشریح در صفحه عروق فمورال، بافت گره تا سطح حفره بیضی بالا میرود، جایی که ورید صافن در صورت قربانی شدن، در محل اتصال صافنوفمورال بخیه زده میشود. نمونه تا زیر رباط اینگوینال، جایی که تقسیم میشود، جدا میشود. اگر بخشی از جراحی برنامهریزیشده باشد، گره کلوکت (پایینترین گره ایلیاک) به عنوان یک نمونه جداگانه برای بررسی برش منجمد ارسال میشود (شکل 3.8).
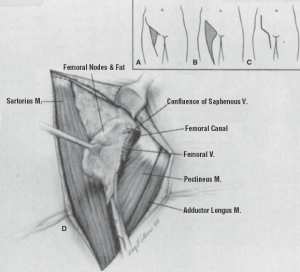 |
| شکل ۳.۷ تکنیک تشریح غدد لنفاوی کشاله ران. الف: مرزهای مثلث فمورال عبارتند از رباط کشاله ران در بالا، عضله خیاطه در طرفین، و عضله نزدیک کننده طویل در وسط. ب: محتویات لنفاوی برداشته شده در طول لنفادنکتومی سطحی کشاله ران شامل محتویات لنفاوی مثلث فمورال و همچنین بافت گرهای است که در سطح عضله مایل خارجی بالاتر از رباط کشاله ران قرار دارد. ج: برش lazy-S که برای لنفادنکتومی کشاله ران استفاده میشود. د: آناتومی تجسم شده در طول لنفادنکتومی کشاله ران. (از Balch CM, Milton GW, Shaw HM, et al., eds. Cutaneous Melanoma. Philadelphia, PA: Lippincott; 1985, with permission.) |
جابجایی عضله سارتوریوس. اگر قرار باشد عضله سارتوریوس جابجا شود، از مبدا آن روی خار خاصره قدامی فوقانی تقسیم میشود (شکل 3.9). عصب پوستی فمورال جانبی در صورت امکان حفظ میشود.
دستههای عصبی عروقی پروگزیمال که به عضله سارتوریوس میروند، برای تسهیل جابجایی تقسیم میشوند، و با دقت سایر دستهها تا حد امکان حفظ میشوند تا از ایجاد یک پایه عروقی اطمینان حاصل شود. عضله چرخانده شده روی عروق فمورال قرار میگیرد و به رباط اینگوینال، فاسیای عضله اداکتور و گروههای عضلانی واستوس متصل میشود.
بستن زخم. لبههای پوست از نظر زنده بودن بررسی میشوند و در صورت لزوم به پوست سالم برگردانده میشوند. تجویز داخل وریدی فلورسئین و به دنبال آن معاینه با استفاده از لامپ وود ممکن است برای شناسایی لبههای پوستی با خونرسانی ضعیف استفاده شود. دو درن ساکشن بسته معمولاً از طریق برشهای کوچک جداگانه در بالا قرار داده میشوند. یکی از آنها به صورت میانی و دیگری به صورت جانبی در داخل زخم جراحی قرار داده میشود. زخم با بخیههای منقطع ۳-۰ قابل جذب رنگ نشده در پوست بسته میشود و پس از آن از منگنههای پوستی استفاده میشود. در برخی از بیماران، از بخیههای نایلونی منقطع در ناحیه چین پوست و بخیههای پیوسته در هر دو قطب استفاده میشود.
مدیریت پس از عمل. بیمار روز بعد از جراحی شروع به راه رفتن میکند. میتوان به مدت ۶ ماه در طول روز از یک جوراب الاستیک سفارشی استفاده کرد. پس از این مدت، در صورت عدم بروز تورم پا، میتوان استفاده از جوراب را قطع کرد. تخلیه ساکشن تا زمانی که میزان خروجی به کمتر از ۳۰ میلیلیتر در روز به مدت ۲ روز متوالی برسد، ادامه مییابد. تقریباً ۳ تا ۴ هفته بعد، کاتترهای ساکشن، صرف نظر از میزان تخلیه، برای کاهش خطر عفونت برداشته میشوند.
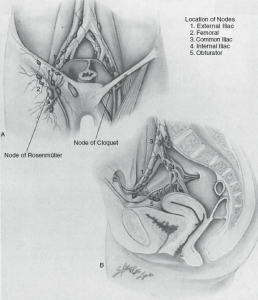 |
| شکل ۳.۸ الف: آناتومی لنفاوی ناحیه کشاله ران که زنجیرههای لنفاوی سطحی و عمقی را نشان میدهد. گره کلوکت در محل اتصال بین گرههای سطحی و عمقی کشاله ران قرار دارد. این گره در زیر رباط کشاله ران در کانال فمورال قرار دارد. ب: گرههای ایلیاک شامل گرههای روی عروق ایلیاک مشترک و سطحی و گرههای ابتوراتور هستند. گرههای ابتوراتور باید به عنوان بخشی از تشریح گره ایلیاک برداشته شوند. (از Balch CM, Milton GW, Shaw HM, et al., eds. Cutaneous Melanoma. Philadelphia, PA: Lippincott; 1985, with permission.) |
تشریح گرههای ایلیاک و اوبتوراتور
کلیات. ما معمولاً تشریح عمیق – تشریح گرههای ایلیاک و اوبتوراتور – را برای موارد زیر انجام میدهیم: (الف) درگیری شناخته شده گرهها که توسط مطالعات تصویربرداری قبل از عمل مشخص شده است، (ب) بیش از سه گره مثبت در نمونه تشریح گره لنفاوی سطحی، یا (ج) بیماری متاستاتیک در گره کلوکت توسط معاینه برش یخ زده.
برش. برای دسترسی به گرههای عمیق، برش پوست را به سمت بالا امتداد میدهیم.
تشریح گره لنفاوی
عضله مایل خارجی از نقطهای در بالای خار ایلیاک قدامی فوقانی تا مرز جانبی غلاف رکتوس شکافته میشود. عضلات مایل داخلی و عرضی شکم شکافته میشوند و صفاق به سمت بالا کشیده میشود. یک روش جایگزین، شکافتن رباط اینگوینال به صورت عمودی، در سمت داخلی ورید فمورال است. حالب در حالی که از روی شریان ایلیاک عبور میکند، نمایان میشود. تشریح در جلوی شریان ایلیاک خارجی ادامه مییابد تا غدد لنفاوی ایلیاک خارجی از هم جدا شوند. در صورت لزوم، شریان و ورید اپیگاستریک تحتانی تقسیم میشوند. تشریح غدد لنفاوی تا محل دو شاخه شدن شریان ایلیاک مشترک ادامه مییابد. غدد لنفاوی جلوی ورید ایلیاک خارجی تا نقطهای که ورید ایلیاک داخلی از زیر شریان ایلیاک داخلی عبور میکند، تشریح میشوند. صفحه صفاق در امتداد دیواره مثانه امتداد مییابد و بافتهای چربی و غدد لنفاوی از چربی اطراف مثانه که از شریان ایلیاک داخلی شروع میشود، تشریح میشوند. تشریح در دیواره داخلی ورید ایلیاک خارجی تکمیل میشود و زنجیره غدد لنفاوی از فاسیای لگنی جدا میشود تا عصب ابتوراتور دیده شود. غدد ابتوراتور در فضای بین ورید ایلیاک خارجی و عصب ابتوراتور (در جهت قدامی-خلفی) و بین شریان ایلیاک داخلی و سوراخ ابتوراتور (در جهت قدامی-خلفی) قرار دارند. شریان و ورید ابتوراتور معمولاً نیازی به دستکاری ندارند.
 |
| شکل ۳.۹ برش عرضی عضله خیاطه از مبدا آن روی خار خاصره قدامی فوقانی در آمادهسازی برای جابجایی روی عروق و اعصاب فمورال. (از Balch CM، Milton GW، Shaw HM و همکاران، ویرایش. ملانوم پوستی. فیلادلفیا، پنسیلوانیا: Lippincott؛ ۱۹۸۵، با اجازه.) |
بستن زخم. عضلات عرضی شکم، مایل داخلی و مایل خارجی ممکن است با بخیههای مداوم بسته شوند. رباط اینگوینال، در صورتی که قبلاً جدا شده باشد، با بخیههای غیرقابل جذب منقطع به رباط کوپر در قسمت میانی و به فاسیای ایلیاک در قسمت جانبی عروق فمورال نزدیک میشود. یک درن ساکشن بسته در فضای عمیق لگن که از طریق یک برش کوچک جداگانه خارج میشود، قرار داده میشود.
مدیریت پس از عمل. درن ساکشن تا زمانی که میزان خروجی ادرار به مدت 2 روز متوالی کمتر از 30 میلیلیتر در روز باشد، ادامه مییابد. درن لگن معمولاً قبل از ترخیص از بیمارستان برداشته میشود. روز بعد از عمل، حرکت توصیه میشود. بیماران پس از عمل برای مدیریت انتظاری ایلئوس احتمالی پس از جراحی عمیق لگن و برای کنترل درد، بستری میشوند.
تشریح گردن
قبلاً اعتقاد بر این بود که متاستاز غدد لنفاوی ناشی از ملانوم در سر و گردن از یک الگوی قابل پیشبینی پیروی میکند. با این حال، اکنون مشخص شده است که درناژ لنفاوی ناشی از ملانوم سر و گردن میتواند چند جهته و غیرقابل پیشبینی باشد. اگر عمل جراحی بر اساس مطالعات آناتومیک کلاسیک و بدون لنفوسنتیگرافی قبل از عمل باشد، ممکن است در ۵۹٪ از بیماران، تشخیص اشتباه انجام شود. این یافتهها قویاً از استفاده از لنفوسنتیگرافی در بیماران مبتلا به ملانوم در ناحیه سر و گردن پشتیبانی میکنند. در بیمارستان MD Anderson، درمان انتخابی برای بیماران مبتلا به ملانوم در ناحیه سر و گردن و غدد لنفاوی درگیر از نظر بالینی، برداشتن وسیع ضایعه اولیه با تشریح رادیکال اصلاحشده گردن یا تشریح انتخابی گردن و به دنبال آن در نظر گرفتن پرتودرمانی کمکی است. ملانومهایی که در پوست سر یا صورت در قدام لاله گوش و بالاتر از محل اتصال لب ایجاد میشوند، میتوانند به غدد لنفاوی داخل پاروتید متاستاز دهند، زیرا این غدد با غدد لنفاوی گردنی مجاور هستند.
هنگامی که غدد لنفاوی داخل پاروتید از نظر بالینی درگیر هستند، توصیه میشود تشریح گردن را با تشریح غدد لنفاوی پاروتید ترکیب کرده و سپس پرتودرمانی کمکی انجام شود.
عوارض جراحی غدد لنفاوی
عوارض مرتبط با SLNB برای ملانوما در ۲۱۲۰ بیمار در تجزیه و تحلیل دادههای کارآزمایی ملانوم Sunbelt ارزیابی شد. در مجموع، ۹۶ نفر (۴.۶٪) از بیماران دچار عوارض عمده یا جزئی مرتبط با SLNB شدند، در حالی که ۱۰۳ نفر (۲۳.۳٪) از ۴۴۴ بیمار عوارض مرتبط با SLNB به همراه تشریح کامل غدد لنفاوی را تجربه کردند. نویسندگان نتیجه گرفتند که SLNB به تنهایی در مقایسه با SLNB به همراه تشریح کامل غدد لنفاوی، با عوارض بسیار کمتری همراه است. مشابه کارآزمایی ملانوم Sunbelt، در MSLT-1، SLNB در مقایسه با برداشتن گسترده ملانوم اولیه به تنهایی، به طور قابل توجهی به عوارض جراحی ملانوما اضافه نکرد.
لنفادنکتومی رسمی با میزان عوارض بالاتر، به ویژه در ناحیه کشاله ران، همراه است. کورمیر و همکارانش به طور آیندهنگر ۵۳ بیمار را در MD Anderson که تحت عمل لنفادنکتومی کشاله ران برای ملانوما قرار گرفته بودند، پیگیری کردند. با استفاده از معیارهای عینی لیبرال، محققان دریافتند که میزان عوارض حاد زخم ۷۷.۴٪، میزان عفونت زخم ۵۴.۷٪ و میزان باز شدن زخم ۵۲.۸٪ است. در تجزیه و تحلیل چند متغیره، تنها شاخص توده بدنی با افزایش عوارض مرتبط بود. میزان عفونت گزارش شده پس از لنفادنکتومی در MSLT-1، ۱۲٪ بود و همچنین اشاره شد که لنفادم بسته به حوضه غدد لنفاوی که تشریح شده بودند، به طور قابل توجهی متفاوت بود (یعنی ۹.۰٪ برای لنفادنکتومی زیر بغل در مقابل ۲۶.۶٪ برای لنفادنکتومی اینگوینال).
لنفادم یکی از جدیترین عوارض طولانی مدت لنفادنکتومی رسمی است. لنفادنکتومی اینگوینال مرتبط با لنفادنکتومی با افزودن تشریح عمیق کشاله ران تغییر قابل توجهی نکرد. علاوه بر این، به نظر نمیرسد تعداد غدد لنفاوی برداشته شده، میزان لنفادن را به طور قابل توجهی تغییر دهد. در مطالعهی کورمیر و همکارانش، میزان لنف ادم در ۳ ماه با استفاده از معیارهای کیفی ۸۵٪ و با استفاده از معیارهای کمی ۴۵٪ برای بیمارانی که تحت لنفادنکتومی اینگوینال قرار گرفتند، بود. ادم اندام تحتانی پس از تشریح کشاله ران را میتوان با اقدامات پیشگیرانه، از جمله آنتیبیوتیکهای قبل از عمل، جورابهای الاستیک، تمرینات بالا بردن پا و داروهای ادرارآور کاهش داد. حتی با اقدامات پیشگیرانه، باید به بیماران توصیه شود که لنف ادم هنوز هم میتواند ایجاد شود. با این وجود، اقدامات پیشگیرانه مهم هستند زیرا معکوس کردن پیشرفت لنف ادم دشوار است.
میزان عوارض برای تشریح غدد لنفاوی زیر بغل کمتر از تشریح اینگوینال است. شایعترین عارضه، سرومای زخم است که از ۳٪ تا ۲۳٪ متغیر است. سایر عوارض رایج شامل سلولیت و لنف ادم (تقریباً ۱۰٪) است. برای همه انواع تشریح غدد لنفاوی، مشکلات فلپ پوستی میتواند رخ دهد. مدیریت انتظاری لبههای ایسکمیک ممکن است منجر به نکروز تمام ضخامت و بستری طولانی مدت در بیمارستان شود. بنابراین، در شرایط غیرمعمول که لبههای فلپ پوستی از نظر زنده بودن مورد تردید هستند، ممکن است بیمار زودتر برای اصلاح فلپ به اتاق عمل بازگردانده شود.
موقعیتهای بالینی خاص
خال مادرزادی غولپیکر
خال مادرزادی غولپیکر به خالهایی گفته میشود که قطر آنها حداقل ۱۵ سانتیمتر یا حداقل دو برابر اندازه کف دست فرد مبتلا باشد. بیماران مبتلا به خال مادرزادی غولپیکر، ۴ تا ۱۰ درصد خطر ابتلا به ملانوما در طول عمر خود دارند. تقریباً نیمی از ملانوماهایی که در خالهای مادرزادی غولپیکر ایجاد میشوند، در ۵ سال اول زندگی ایجاد میشوند.
تصمیمگیری در مورد مدیریت خالهای مادرزادی غولپیکر دشوار است، زیرا چنین ضایعاتی اغلب آنقدر گسترده هستند که برداشتن جراحی پیشگیرانه غیرممکن است. هنگامی که محل و اندازه ضایعه اجازه برداشتن پیشگیرانه را میدهد، برداشتن باید قبل از سن ۲ سالگی در نظر گرفته شود. اگرچه دادهها محدود هستند، اما شاخصهای پیشآگهی منفی بالقوه که ممکن است به تصمیمگیری کمک کنند شامل اندازه بزرگ و وجود ضایعات ماهوارهای است.
ملانوم متاستاتیک با محل اولیه ناشناخته
تقریباً ۱ تا ۸ درصد از بیماران مبتلا به ملانوما با بیماری متاستاتیک از ملانوما با محل اولیه ناشناخته (MUP) مراجعه میکنند. شایعترین محل بروز در حوضه غدد لنفاوی زیر بغل است (بیش از 50٪). محل شایع بعدی بروز، حوضه غدد لنفاوی گردن است.
دلایل مختلفی برای پدیده محل MUP مطرح شده است. عنبری و همکارانش احتمالات زیر را برای ضایعات اولیه مطرح کردند: ملانومای تشخیص داده نشده، ملانومای درمان شدهای که در ابتدا به اشتباه تشخیص داده شده بود، ملانومای خودبهخود پسرفت کرده و تبدیل بدخیم ملانوسیتی که به محل متاستاتیک منتقل شده بود.
برای اینکه ملانوم متاستاتیک به عنوان محل MUP طبقهبندی شود، تشخیص بافتشناسی باید تأیید شود، بیوپسیها و/یا برشهای قبلی، در صورت وجود، باید برای تشخیص احتمالی ملانوم ارزیابی شوند و محلهای اولیه کمتر شایع برای ملانوم باید به طور کامل ارزیابی شوند. یک شرح حال کامل همچنین ممکن است ضایعه قبلی را که برداشته یا تخریب شده است، اما هرگز بیوپسی نشده است، شناسایی کند. اگر ضایعه متاستاتیک به حوضه غدد لنفاوی باشد، نواحی زهکشی آن حوضه باید به دقت بررسی شوند. علاوه بر این، بیماران باید تحت ارزیابی مرحلهبندی با سیتیاسکن قفسه سینه، شکم و لگن (همچنین شامل سیتیاسکن گردن در صورت مناسب بودن آناتومیک) و امآرآی مغز قرار گیرند.
مطالعات متعددی بقای این بیماران را با گروههای مشابه با وضعیت گره لنفاوی معادل و محل اولیه شناخته شده مقایسه کردهاند. اگرچه از نظر تاریخی اعتقاد بر این بود که بیماران با تومورهای اولیه ناشناخته پیشآگهی بدتری دارند، مطالعات اخیر با یافتههای قبلی مغایرت داشته و نشان دادهاند که بیماران مبتلا به MUP سابقه طبیعی مشابه (اگر نه بهتر از) بقای بسیاری از بیماران مبتلا به بیماری مرحله III دارند. با توجه به مشخصات بقای آنها، چنین بیمارانی با بیماری گره لنفاوی باید در مرحله III مرحلهبندی شوند و مشابه بیماران مرحله III با ملانوم اولیه شناخته شده درمان شوند، از جمله در نظر گرفتن آزمایشات بالینی مرحله III.
مدیریت بیماری غیر گرهای موضعی-منطقهای
پیشینه
وجود بیماری غیر گرهای موضعی-منطقهای که از نظر بالینی یا میکروسکوپی قابل تشخیص باشد، میتواند به طور کلی به سه گروه طبقهبندی شود:
- متاستازهای در حال گذر (که به طور کلاسیک به عنوان متاستازهای پوستی یا زیر جلدی بیش از 2 سانتیمتر از ضایعه اولیه تعریف میشوند اما فراتر از حوضه گرهای منطقهای نیستند).
- متاستازهای ماهوارهای (که به طور کلاسیک به عنوان ضایعات پوستی یا زیر جلدی در فاصله 2 سانتیمتر از تومور اولیه تعریف میشوند).
- بیماری ریزماهوارهای (بیماری میکروسکوپی پوستی و/یا زیر جلدی که در مجاورت تومور اولیه یافت میشود، اما از آن جدا نیست و صرفاً توسط فیبروز یا التهاب جدا نشده است).
الگوهای عود ماهوارهای/در حال گذر نسبتاً منحصر به ملانوما هستند و در 3 تا 10 درصد موارد ملانوما رخ میدهند. اگرچه عوامل مولکولی و پاتوفیزیولوژی بیماری در حال گذار به خوبی شناخته نشدهاند، اما احتمالاً تظاهر داخل لنفاوی متاستازهای ملانوما هستند. پیشبینیکنندههای مستقل عود در حال گذار در میان بیمارانی که تحت بیوپسی غدد لنفاوی نگهبان قرار گرفتهاند شامل سن بالای 50 سال، تومور اولیه اندام تحتانی، افزایش ضخامت تومور، زخم و درگیری غدد لنفاوی است. متاستازهای منطقهای غدد لنفاوی در حدود دو سوم بیماران مبتلا به بیماری در حال گذار رخ میدهد و در صورت وجود، با میزان بقای پایینتری همراه است. سایر پیشبینیکنندههای گزارششده متاستاز دوردست در میان بیماران مبتلا به عود در حال گذار شامل وضعیت مثبت SLN، اندازه تومور در حال گذار حداقل 2 سانتیمتر و فاصله زمانی بدون بیماری قبل از عود در حال گذار کمتر از 12 ماه است. دادهها نشان میدهد بیمارانی که با بیماری همزمان، دوردست و در حال گذار مراجعه میکنند، در مقایسه با بیمارانی که فقط با بیماری در حال گذار یا بیماری دوردست مراجعه میکنند، بقای مختص بیماری بدتری دارند. از نظر تاریخی، برخی اظهار داشتهاند که تشریح حوضه گره لنفاوی منطقهای – چه با SLNB (به بخش زیر مراجعه کنید) و چه با لنفادنکتومی کامل – خطر متاستازهای در حال عبور را افزایش میدهد. این نویسندگان فرضیهای مطرح کردند که تشریح، جریان لنفاوی را مختل میکند و منجر به رسوب سلولهای متاستاتیک در رگهای لنفاوی مداخلهگر میشود. با این حال، تجزیه و تحلیل انتقادی دادهها، شواهد قانعکنندهای ارائه داد که نه SLNB و نه تشریح کامل غدد لنفاوی در بیماران SLN مثبت، میزان متاستازهای در حال عبور را افزایش نمیدهند. در یک بررسی مشترک توسط دکتر اندرسون و واحد ملانومای سیدنی از ۳۴۰۰ بیمار مبتلا به ملانومای اولیه با حداقل ضخامت ۱ میلیمتر که طی یک دوره ۱۰ ساله در واحد ملانومای سیدنی تحت درمان قرار گرفتند، تفاوت معنیداری در میزان متاستازهای در حال عبور بین بیمارانی که فقط با برداشتن گسترده (۴.۹٪) و بیمارانی که با برداشتن گسترده و SLNB (۴.۵٪) درمان شدند، وجود نداشت. از آنجا که دو گروه از نظر عمق متوسط تومور، درصد تومورهای زخمی و سطح کلارک مشابه بودند، این دادهها قویاً از این مفهوم پشتیبانی میکنند که مداخله زودهنگام غدد لنفاوی تأثیر کمی بر سیر طبیعی متاستازهای در حال عبور دارد.
در یک مطالعه جداگانه از ۱۳۹۵ بیمار از مرکز سرطان MDAnderson دانشگاه تگزاس، بیماران با SLN مثبت، میزان متاستازهای در حال عبور (۱۲٪) به طور قابل توجهی بالاتر از بیماران با SLN منفی (۳.۵٪) داشتند. در مجموع، این دادهها نشان میدهد که زیستشناسی – نه تکنیک جراحی – خطر متاستازهای در حال عبور را تعیین میکند.
رویکرد درمان
گزینههای درمانی برای بیماران مبتلا به بیماری غیر گرهای موضعی-منطقهای شامل جراحی، رویکردهای منطقهای و درمان سیستمیک است. بیماران مبتلا به متاستازهای در حال عبور که محدود به اندامی هستند که با اقدامات جراحی استاندارد قابل درمان نیستند (به عنوان مثال، بیماران مبتلا به متاستازهای مکرر و/یا متعدد در حال عبور و بیماران مبتلا به بیماری در حال عبور با بار زیاد) یک چالش درمانی منحصر به فرد را ایجاد میکنند. گزینههای موضعی-منطقهای شامل تکنیکهای شیمیدرمانی منطقهای مانند پرفیوژن اندام ایزوله یا تزریق اندام ایزوله یا درمان داخل ضایعهای است. قطع عضو به ندرت توصیه میشود.
پرفیوژن اندام ایزوله هیپرترمیک
پرفیوژن اندام ایزوله هیپرترمیک (HILP) با ملفالان از اواسط دهه 1950 برای درمان متاستازهای در حال عبور اندامها استفاده شده است. با این روش، تشریح رسمی غدد لنفاوی انجام میشود که امکان دسترسی به عروق حیاتی مورد نظر را فراهم میکند. متعاقباً، کانولهایی وارد میشوند و اندام پس از استفاده از شریانبند، روی یک مدار بایپس خارج بدنی (اکسیژندار) قرار میگیرد و به طور مؤثر اندام را از گردش خون سیستمیک جدا میکند. ملفالان در حال حاضر فعالترین عامل منفرد برای استفاده در HILP است. میزان پاسخ کلی 64٪ تا 100٪ (میانگین نرخ پاسخ کامل 58٪) قابل دستیابی است و میانگین مدت زمان پاسخ در بیماران با پاسخ کامل از 9 تا 19 ماه متغیر است. مطالعات غیرتصادفی روی پرفیوژن اندام هیپرترمیک توسط لینارد و همکارانش، میزان پاسخ کامل بالایی (90%) را با ترکیبی از ملفالان، فاکتور نکروز تومور-α (TNF-α) و اینترفرون-γ (IFN-γ) و میزان پاسخ تا حدودی پایینتری را با ملفالان به تنهایی (52%) گزارش کردند. فرکر و همکارانش میزان پاسخ ۱۰۰٪ را در بیمارانی که تنها با ملفالان درمان شده بودند و میزان پاسخ ۹۰٪ را در بیمارانی که با ملفالان، IFN-γ و TNF-α درمان شده بودند، گزارش کردند، اگرچه ترکیب دوم منجر به میزان پاسخ کامل بالاتری شد (۸۰٪ در مقابل ۶۱٪). یک کارآزمایی تصادفی چند مرکزی که توسط گروه انکولوژی کالج جراحان آمریکا حمایت مالی میشد، ملفالان به تنهایی را با ترکیبی از ملفالان و TNF-α برای بیمارانی که متاستاز در حال انتقال داشتند، مقایسه کرد، اما به دلیل اینکه تجزیه و تحلیل موقت نتوانست فایدهای برای TNF-α نشان دهد، به زودی به جمعبندی نهایی نرسید. بنابراین، TNF-α در ایالات متحده برای پرفیوژن اندام ایزوله در دسترس نیست. استفاده معمول از HILP در شرایط کمکی، فایدهای جزئی یا حتی ناچیز دارد. اگرچه یک کارآزمایی تصادفی چند مرکزی فاز III روی ۸۶ بیمار (هافستروم و همکاران) افزایش فاصله زمانی بدون بیماری را در بیماران مبتلا به متاستازهای درونگذر و متاستاز غدد لنفاوی منطقهای نشان داد، اما این اثر گذرا بود و عمدتاً در بیمارانی با پیشآگهی مطلوبتر (ضخامت تومور ۱.۵ تا ۲.۹۹ میلیمتر) رخ داد. این مطالعه هیچ مزیتی از پرفیوژن اندام ایزوله از نظر زمان تا متاستاز دوردست یا مدت زمان بقا نشان نداد. اگرچه HILP ممکن است یک گزینه درمانی مؤثر برای بیماران مبتلا به متاستازهای درونگذر باشد، اما این تکنیک پیچیده و تهاجمی است. برای رفع این چالشها، تکنیک تزریق کم تهاجمی اندام ایزوله توسعه داده شد.
تزریق اندام ایزوله
تزریق اندام ایزوله اساساً یک پرفیوژن اندام ایزوله با جریان کم و تهاجمی است که از طریق کاتترهای پوستی انجام میشود، اما بدون اکسیژنرسانی به مدار (شکل ۳.۱۰). با استفاده از تکنیکهای استاندارد رادیولوژی، کاتترها از طریق پوست به داخل شریان و ورید اصلی اندام سالم وارد میشوند (یا میتوانند در شریان و ورید اصلی اندام آسیبدیده، یعنی شریان و ورید بازویی یا پوپلیتئال قرار داده شوند). تحت بیهوشی عمومی، پس از باد کردن یک تورنیکه پنوماتیک در قسمت پروگزیمال، عوامل سیتوتوکسیک (عموماً ملفالان و اکتینومایسین-D) از طریق کاتتر شریانی تزریق شده و به مدت 20 تا 30 دقیقه با تکنیک سرنگ به صورت دستی “به گردش در میآیند”. هیپوکسی پیشرونده رخ میدهد زیرا، برخلاف پرفیوژن اندام ایزوله، از اکسیژناتور استفاده نمیشود. هیپوکسی و اسیدوز مرتبط با تزریق اندام ایزوله از نظر درمانی جذاب هستند زیرا به نظر میرسد عوامل سیتوتوکسیک متعددی، از جمله ملفالان، در شرایط هیپوکسیک به طور مؤثرتری به سلولهای تومور آسیب میرسانند. گزارش شده است که هیپوکسی و اسیدوز اثرات سیتوتوکسیک ملفالان را در مدلهای تجربی افزایش میدهند. پس از اتمام قرار گرفتن در معرض دارو، عروق اندام از طریق کاتتر شریانی با محلول کریستالوئیدی شستشو داده میشود و مایع خروجی دور ریخته میشود. اگرچه بافتهای اندام فقط برای مدت کوتاهی (تا 30 دقیقه) در معرض عامل سیتوتوکسیک قرار میگیرند، اما نشان داده شده است که این روش میزان پاسخ تقریباً مشابه با میزان مشاهده شده پس از HILP معمولی را نشان میدهد. میزان پاسخ کلی 85٪ (میزان پاسخ کامل، 41٪؛ میزان پاسخ جزئی، 44٪) در حداقل یک مطالعه به دست آمده است. یک مطالعه چند موسسهای توسط بیزلی و همکارانش، میزان پاسخ کامل 31٪ و میزان پاسخ جزئی 33٪ را نشان داد. به دلیل سادگی نسبی تکنیک تزریق ایزوله، ممکن است گزینه جذابتری برای بیماران مبتلا به بیماریهای همراه یا سالمندان باشد و به طور کلی بیشتر از HILP مورد استفاده قرار میگیرد.
سمیت و عوارض تزریق HILP و اندام ایزوله
HILP و تزریق اندام ایزوله میتواند با عوارض جانبی منطقهای بالقوه قابل توجهی، از جمله میونکروز، آسیب عصبی، سندرم کمپارتمان و ترومبوز شریانی همراه باشد که گاهی اوقات نیاز به فاشیوتومی یا به ندرت قطع عضو دارد. پس از تزریق اندام ایزوله، به نظر میرسد عوارض جانبی منطقهای مشابه مواردی است که پس از HILP معمولی گزارش شده است، به طوری که 41٪ از بیماران اثرات سمی درجه II و 53٪ اثرات سمی درجه III را تجربه میکنند. سمیت سیستمیک، از جمله افت فشار خون و سندرم دیسترس تنفسی بزرگسالان، گاهی اوقات با افزودن TNF-α به رژیم پرفیوژن یا تزریق دیده شده است. برای جلوگیری از آسیب کلیوی ثانویه به سطح بالای کراتین فسفوکیناز، ممکن است نیاز به افزایش میزان احیای مایعات باشد و قلیایی کردن ادرار از نظر تئوری فوایدی دارد. استروئیدها به صورت تجربی برای کاهش میزان آسیب عضلانی استفاده شدهاند. شایان ذکر است که اوج سطح کراتین فسفوکیناز عموماً در روز اول پس از عمل برای پرفیوژن اندام ایزوله و روز چهارم برای تزریق اندام ایزوله است. از آنجا که هم پرفیوژن اندام و هم تزریق نیاز به تخصص فنی بالایی دارند و با خطر قابل توجهی از عوارض همراه هستند، این روشها فقط باید در مراکزی انجام شوند که در این تکنیک تجربه دارند. در حال حاضر، شواهد کمی برای توجیه استفاده از پرفیوژن یا تزریق پیشگیرانه، به جز به عنوان بخشی از یک کارآزمایی بالینی، وجود دارد.
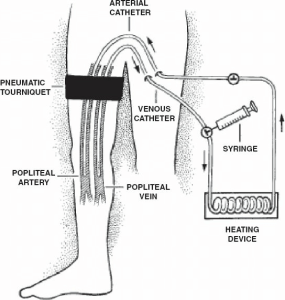 |
| شکل 3.10 طرح شماتیکی که تزریق دارو به اندام ایزوله را نشان میدهد. کاتترها معمولاً توسط یک رادیولوژیست مداخلهای از طریق اندام مقابل به صورت زیر جلدی قرار داده میشوند، به طوری که نوک کاتتر در اندام دارای تومور درست زیر رباط اینگوینال در شریان و ورید فمورال سطحی قرار میگیرد. پس از باد کردن تورنیکه، شیمیدرمانی به مدت 20 تا 30 دقیقه به صورت دستی تزریق میشود و پس از آن اندام با محلول نمکی نرمال شسته میشود. (بازنشر از Lindner P, Doubrovsky A, Kam PC, et al. عوامل پیشآگهی پس از تزریق دارو به اندام ایزوله با عوامل سیتوتوکسیک برای ملانوما. Ann Surg Oncol 2002;9:127–136، با اجازه.) |
درمان داخل ضایعهای
مفهوم درمان داخل ضایعهای برای بیماری موضعی-منطقهای در حال انتقال (یا به طور کلیتر برای سایر متاستازهای قابل دسترس) در ملانوما چیز جدیدی نیست؛ اخیراً، برخی از این عوامل نتایج امیدوارکنندهای نشان دادهاند. مزیت بالقوه چنین استراتژی این است که یک رویکرد هدفمند مستقیم ممکن است با سمیت سیستمیک محدود همراه باشد و در عین حال پاسخ ایمنی موضعی مطلوبی را ایجاد کند. از نظر تاریخی، این رویکرد برای بیمارانی با بیماری IIIB و IIIC مرحله IIIB غیرقابل جراحی، چندگانه یا پیشرفته موضعی و همچنین بیماران مبتلا به بیماری M1a قابل دسترس در نظر گرفته شده است.
یکی از اولین عوامل به کار رفته، باسیلوس کالمت-گرین (BCG) در اواسط تا اواخر قرن بیستم بود. گزارشهای اولیه مورتون و همکارانش نه تنها پسرفت قابل توجه تومور را در اکثر ضایعات تزریق شده نشان داد، بلکه القای فعالیت ضد توموری میزبان را در مکانهای تزریق نشده منطقهای و دور، علیرغم عدم وجود هرگونه پاسخ احشایی واقعی، نشان داد. با گسترش استفاده از BCG داخل ضایعه، برخی از سمیتهای قابل توجه از جمله واکنشهای آلرژیک شدید و آنافیلاکسی و مرگ ناشی از BCG منتشر گزارش شد. اگرچه چندین کارآزمایی غیرتصادفی با استفاده از گروههای کنترل تاریخی و دو کارآزمایی تصادفی کوچک BCG داخل ضایعه یا داخل لنفاوی، مزیت آماری معنیداری را برای سیستم ایمنی به نفع BCG نشان دادند، اما کارآزماییهای تصادفی نتوانستند این یافتهها را اثبات کنند. عوامل متعدد داخل ضایعهای مورد بررسی قرار گرفتهاند که بسیاری از آنها در حال حاضر در کارآزماییهای بالینی هستند.
PV-10 یک محلول استریل و غیرتبزا از 10٪ دیسدیم رز بنگال، یک مشتق فلورسئین، است. تزریق داخل ضایعهای PV-10 منجر به نکروز داخل توموری و التهاب موضعی میشود که تولید قطعات تومور نئوآنتیژنیک و ارائه آنها به سلولهای ارائهدهنده آنتیژن را تسهیل میکند. یک مطالعه فاز II که توسط موسسه ملانوما استرالیا انجام شد، میزان پاسخ کلی 51٪ برای ضایعات هدف و میزان پاسخ کامل 26٪ را نشان داد. میانگین زمان پاسخدهی ۱.۹ ماه، میانگین مدت زمان پاسخدهی ۴.۰ ماه و ۸٪ از بیماران پس از ۵۲ هفته بدون هیچ نشانهای از بیماری بودند.
استراتژی داخل ضایعهای T-VEC (talimogene laherparepvec) از نقش تزریق تحریککننده کلونی گرانولوسیت ماکروفاژ (GM-CSF) و سهم نظری آن در ایمنی ضد تومور بهره میبرد. این عامل یک ویروس هرپس سیمپلکس انکولیتیک ضعیف شده است که برای بیان ژن GM-CSF اصلاح شده است و همچنین قادر به تکثیر انتخابی در سلولهای تومور است. تصور میشود که اثر ضد توموری به دلیل ترکیبی از انکولیز مستقیم ناشی از عفونت ویروسی و تکثیر لیتیک و همچنین القای پاسخ ایمنی سیستمیک باشد.
در یک کارآزمایی فاز III که توسط Andtbacka و همکارانش گزارش شده است، ۴۳۶ بیمار ثبت نام شده و به صورت تصادفی به دو گروه T-VEC یا GM-CSF (گروه کنترل) تقسیم شدند. همه بیماران مبتلا به ملانومای غیرقابل جراحی و تزریقی مرحله III یا IV با بار بیماری احشایی محدود بودند. T-VEC هر 2 هفته یکبار به صورت تزریق داخل ضایعه تجویز شد، در حالی که در گروه دیگر، GM-CSF روزانه به مدت 14 روز در هر چرخه 28 روزه به صورت زیر جلدی تجویز شد. میزان پاسخ پایدار (که به صورت ≥6 ماه تعریف میشود) که هدف اصلی آزمایش است، در بیمارانی که T-VEC دریافت کردند (16.3٪ در مقابل 2.1٪) و همچنین میزان پاسخ کلی (26.4٪ در مقابل 5.7٪) به طور قابل توجهی افزایش یافت. برخی از اثرات ضد توموری در تقریباً 1/3 ضایعات تزریق نشده و در کمی بیش از 10٪ از نواحی احشایی مشاهده شد. بقای کلی (OS) به طور کلی در بین گروههای آزمایش تفاوت معنیداری نداشت. با این حال، در تجزیه و تحلیل زیرمجموعه، به نظر میرسد که در بیماران مبتلا به بیماری مرحله III یا IV (M1a) مزیت بقا وجود دارد (OS 4 ساله 32٪ در مقابل 21٪، HR 0.57، 95٪ CI 0.40 تا 0.80). درمان با T-VEC به خوبی تحمل شد. عوارض جانبی گزارش شده معمولاً شامل خستگی، لرز، تب و سایر علائم سیستمیک شبیه آنفولانزا بود. بر اساس این نتایج بالینی مثبت، در سال 2015، T-VEC اولین درمان داخل ضایعهای بود که توسط FDA برای درمان موضعی ضایعات پوستی، زیر جلدی و غدد لنفاوی غیرقابل جراحی در بیماران مبتلا به ملانوم عودکننده پس از جراحی اولیه تأیید شد. تلاشهای اخیر تلاش کردهاند تا بر موفقیت ILI و درمان داخل ضایعهای (به ویژه T-VEC) مطابق با شتاب حاصل از استراتژیهای ترکیبی، تأکید کنند. آریان و همکارانش ایمنی و اثربخشی ترکیب ایپیلیموماب با ILI را در بیماران مبتلا به بیماری در حال گذار بررسی کردند. گزارشهای اولیه آنها نشان میدهد که این یک ترکیب ایمن و مؤثر است، با نرخ پاسخ ۸۹٪ در ۳ ماه (۶۵٪ CR) و بقای بدون پیشرفت (PFS) در ۱ سال ۵۷٪. فقط ۱۸ بیمار ثبتنام کردند و آنچه باید دید این است که آیا این نتایج، پاسخ یا دوام مونوتراپی ILI را با ادامهی پیگیری و تعهد افزایش میدهد یا خیر. آزمایشهای ترکیبی مبتنی بر T-VEC نیز در حال انجام است، در ترکیب با ایپیلیموماب و سایر مهارکنندههای ایست بازرسی ایمنی، و در مراحل اولیه بیماری (یعنی نئوادجوانت).
درمان کمکی برای بیماریهای موضعی-منطقهای
اینترفرون آلفا-2b
دوز بالای IFN آلفا-2b توسط سازمان غذا و داروی آمریکا (FDA) به عنوان درمان کمکی برای بیماران مبتلا به ملانوم که در دو دهه گذشته خطر عود بالایی داشتهاند، تأیید شده است. بیمارانی که بیماری موضعی پیشرفته، عودکننده، گرهای، در حال انتقال یا اقماری دارند، کاندیدای دریافت دوز بالای IFN آلفا-2b به عنوان درمان کمکی در نظر گرفته شدهاند.
تأیید IFN آلفا-2b بر اساس نتایج کارآزمایی تصادفی آیندهنگر گروه انکولوژی تعاونی شرقی (ECOG) E1684 انجام شد که 287 بیمار را به دو گروه دریافت دوز بالای IFN آلفا-2b یا مشاهده پس از برداشتن گسترده تومور اختصاص داد. دوز IFN آلفا-2b، 20 میلیون واحد در متر مربع در روز به صورت داخل وریدی به مدت 4 هفته و به دنبال آن 10 میلیون واحد در متر مربع سه بار در هفته به صورت زیر جلدی به مدت 48 هفته بعدی بود. هر دو گروه بیماران با غدد لنفاوی مثبت و پرخطر با غدد لنفاوی منفی (T4pN0) گنجانده شدند؛ اکثر بیماران پس از برداشتن گسترده قبلی، بیماریشان در غدد لنفاوی منطقهای عود کرده بود. همه بیماران تحت عمل جراحی ELND یا TLND قرار گرفتند. از 287 بیمار ثبتنامشده، 89٪ غدد لنفاوی مثبت داشتند. IFN alfa-2b میانگین بقای کلی (OS) را از 2.8 به 3.8 سال و میزان بقای 5 ساله بدون عود (RFS) را از 26٪ به 37٪ در پیگیری متوسط 7 ساله بهبود بخشید. اثر مفید IFN alfa-2b در بیماران با غدد لنفاوی مثبت بیشتر مشهود بود. نکته قابل توجه این است که میزان اثرات سمی بالا بود: دو بیمار فوت کردند، 67٪ از بیماران اثرات سمی درجه 3 را تجربه کردند و 50٪ از بیماران یا درمان را زود متوقف کردند یا نیاز به کاهش دوز داشتند. یک تحلیل بهروز شده از E1684، با میانگین پیگیری ۱۲.۶ سال، افزایش مداومی را در میانگین بقای بدون بیماری نشان داد (۴۵.۸ ماه برای گروه IFN alfa-2b در مقابل ۳۲ ماه برای گروه تحت نظر). با این حال، تفاوت بقای کلی دیگر از نظر آماری معنیدار نبود، احتمالاً به این دلیل که مرگ و میر ناشی از بیماریهای همزمان در هر دو گروه، مرگ و میر ناشی از ملانوما را تحت الشعاع قرار داده بود.
کارآزمایی E1690، یکی دیگر از کارآزماییهای ECOG، قبل از اینکه تأثیر قابل توجهی بر بقا در E1684 مشاهده شود، آغاز شد. در E1690، که به عنوان تأیید و ادامه E1684 طراحی شده بود، ۶۴۲ بیمار مبتلا به ملانوما با ریسک بالا (مرحله IIB یا III) در یک مطالعه سه گروهی به صورت تصادفی برای دریافت رژیم دوز بالای E1684، دوز پایین IFN alfa-2b (۳ میلیون واحد در متر مربع سه بار در هفته به مدت ۲ سال) یا فقط تحت نظر قرار گرفتن، انتخاب شدند. هفتاد و پنج درصد از بیماران متاستاز غدد لنفاوی داشتند (50٪ بیماری عودکننده در غدد لنفاوی منطقهای داشتند). برخلاف E1684، E1690 اجازه ورود بیماران با تومورهای اولیه T4 را میداد، صرف نظر از اینکه تشریح غدد لنفاوی انجام شده باشد یا خیر، و 25٪ از بیماران در این کارآزمایی تومورهای اولیه عمیق داشتند (در مقایسه با 11٪ در E1684).
در E1690، در یک پیگیری متوسط 52 ماهه، IFN alfa-2b با دوز بالا، مزیت RFS را بیش از IFN alfa-2b با دوز پایین یا تحت نظر بودن نشان داد. میزان RFS تخمینی 5 ساله برای IFN alfa-2b با دوز بالا، IFN alfa-2b با دوز پایین و تحت نظر بودن به ترتیب 44٪، 40٪ و 35٪ بود (0.03 = P). مزیت RFS برای بیماران با غدد لنفاوی منفی و مثبت معادل بود. هیچکدام از دوزهای بالا و پایین اینترفرون آلفا-2b در مقایسه با گروه تحت نظر، مزیت بقای کلی (OS) را نشان ندادند.
تحلیلی بر درمان نجاتبخش برای بیمارانی که بیماریشان در E1690 عود کرده بود، نشان داد که بخش قابل توجهی بزرگتری از بیماران در گروه تحت نظر نسبت به گروه تحت نظر با دوز بالا، درمان نجاتبخش حاوی اینترفرون آلفا دریافت کردند، که ممکن است تفسیر مزیت بقای درمانهای تعیینشده را مختل کرده باشد. برخی از اختلافات بین یافتههای E1684 و E1690 ممکن است به تفاوت در پروفایلهای جمعیتی بیماران نسبت داده شود. E1690 شامل بیمارانی با ویژگیهای بیماری مطلوبتر بود: تنها 75٪ از بیماران از نظر غدد لنفاوی مثبت بودند و از این تعداد، 51٪ عود غدد لنفاوی داشتند. در E1690، 25٪ از بیماران ثبتنامشده در مرحله بالینی II بودند؛ در E1684، 11٪ در مرحله پاتولوژیک II بودند. احتمالاً، برخی از بیماران مرحله بالینی II در E1690 در صورت نیاز به لنفادنکتومی، در مرحله پاتولوژیک III قرار میگرفتند. یک تجزیه و تحلیل بهروز شده از E1690 با میانگین پیگیری 7.2 سال، نتایج اولیه مطالعه را تأیید کرده است. علاوه بر این، تجزیه و تحلیل ترکیبی ECOG 1684 و ECOG 1690 نشان داد که IFN با دوز بالا منجر به بهبود بقای بدون بیماری در مقایسه با دارونما میشود، اما هیچ مزیتی در رابطه با بقای کلی وجود ندارد.
کارآزمایی ECOG E1694 برای مقایسه اثربخشی و ایمنی واکسن گانگلیوزید با اثربخشی و ایمنی IFN آلفا-2b با دوز بالا در بیماران مبتلا به ملانوم مرحله IIB یا مرحله III آغاز شد. گانگلیوزید GM2 یک آنتیژن ملانوم از نظر سرولوژیکی به خوبی تعریف شده و گانگلیوزید ایمونوژنیک است که بر روی سلولهای ملانوم بیان میشود. مطالعات اولیه نشان داده بود که پاسخ آنتیبادی به GM2 با عدم عود و بقای کلی مرتبط است. در E1694، 774 بیمار واجد شرایط مبتلا به ملانوم پرخطر (ضخامت تومور >4 میلیمتر یا متاستاز غدد لنفاوی منطقهای) به صورت تصادفی برای دریافت دوز بالای واکسن IFN alfa-2b یا GM2 انتخاب شدند. این مطالعه به دلیل برتری آشکار IFN alfa-2b از نظر عدم ابتلا به بیماری و بقای کلی، توسط هیئت نظارت بر ایمنی دادهها زودتر از موعد مقرر خاتمه یافت.
میزان تخمینی RFS دو ساله در گروه دوز بالای IFN آلفا-2b در زیرگروهها بر اساس تعداد غدد لنفاوی، 62٪ بود که برتری IFN آلفا-2b را نسبت به GM2 در تمام زیرگروههای غدد لنفاوی نشان داد.
E1694 همچنین مزیت آماری معنیداری را برای IFN آلفا-2b در بیماران پرخطر بدون گره لنفاوی نشان داد. یک متاآنالیز ترکیبی از دادههای اولیه از کارآزماییهای ECOG/بینگروهی IFN با دوز بالا (N = 1916) مزیت واضحی از IFN آلفا-2b با دوز بالا را از نظر RFS و مزیت متوسطتری را از نظر بقای کلی نشان داد (نسبت شانس = 0.9، P = 0.05). دادههای حاصل از تجزیه و تحلیل بهروز شده از پایگاه داده ECOG نشان داد که (الف) تأثیر IFN آلفا-2b بر بقا محدود به رژیمهایی بود که هم القای دوز بالا و هم نگهداری زیر جلدی با دوز بالا را در بر میگرفتند. (ب) کاهش خطر در مراحل اولیه مشاهده شد؛ و (ج) مزیت RFS پس از درمان نیز پایدار ماند، برخلاف مزیت RFS محدودتر گزارش شده توسط آزمایشهای دوز پایین.
نتایج آزمایشهایی که IFN آلفا-2b با دوز پایین را بررسی کردهاند، ناامیدکننده بودهاند. آزمایش E1690 که قبلاً ذکر شد، یک آزمایش سه بازویی که IFN آلفا-2b با دوز پایین را به عنوان یکی از درمانها در نظر گرفته بود، هیچ بهبود قابل توجهی در RFS در بیماران مبتلا به ملانومای پرخطر مرحله II یا مرحله III که به مدت 2 سال IFN آلفا-2b با دوز پایین دریافت کرده بودند، نشان نداد. بهبود متوسط در گروه IFN آلفا-2b با دوز پایین در مقایسه با گروه کنترل، ظرف 2 سال پس از قطع درمان از بین رفت. آزمایش سازمان اروپایی تحقیقات و درمان سرطان (EORTC) 18871 همچنین نشان داد که تزریق زیر جلدی اینترفرون آلفا-2b با دوز بسیار پایین (1 میلیون واحد در هر متر مربع) به صورت زیر جلدی در روزهای متناوب به مدت 1 سال، بر بقای کلی بیماران مبتلا به ملانوم پرخطر تأثیری ندارد. به دلیل عدم وجود یک مزیت بالینی پایدار و قابل اثبات، اینترفرون آلفا-2b با دوز پایین به عنوان درمان کمکی برای ملانوم در ایالات متحده تأیید نشده است. به طور مشابه، اینترفرون با دوز متوسط با EORTC 18952 مورد مطالعه قرار گرفت. هیچ مزیتی در مورد عدم ابتلا به بیماری یا بقای کلی نشان داده نشد.
در مارس 2011، سازمان غذا و داروی آمریکا (FDA) PEG-IFN آلفا-2b را برای درمان کمکی ملانوم با درگیری میکروسکوپی یا آشکار غدد لنفاوی تأیید کرد. این درمان باید ظرف 84 روز پس از برداشتن قطعی غدد لنفاوی از جمله لنفادنکتومی کامل آغاز شود و به صورت تزریق زیر جلدی یک بار در هفته که ممکن است توسط خود بیمار تزریق شود، تجویز میشود. دوز توصیهشده ۶ میکروگرم بر کیلوگرم در هفته به صورت زیرجلدی برای ۸ دوز و به دنبال آن ۳ میکروگرم بر کیلوگرم در هفته به صورت زیرجلدی تا ۵ سال است. تأیید بر اساس EORTC 18991، یک کارآزمایی چند مرکزی با برچسب باز که ۱۲۵۶ بیمار را ثبتنام کرده بود، انجام شد. بیمارانی که برداشتن جراحی کافی از ملانوم پوستی اولیه و غدد لنفاوی منطقهای درگیر داشتند، به صورت تصادفی به دو گروه دریافتکننده PEG-IFN alfa-2b یا مشاهده به مدت ۵ سال تقسیم شدند. عوامل طبقهبندی شامل نوع درگیری غدد لنفاوی (میکروسکوپی در مقابل آشکار)، تعداد غدد لنفاوی مثبت (۱، ۲ تا ۴، ۵ یا بیشتر، یا ارزیابی نشده)، ضخامت اولیه برسلو (<۱.۵ میلیمتر، ≥۱.۵ تا ۴ میلیمتر، ≥۴ میلیمتر)، زخم تومور اولیه (وجود یا عدم وجود یا ناشناخته)، جنسیت و مرکز مطالعه بود. بیماران برای عود موضعی و منطقهای یا متاستازهای دوردست هر 3 ماه یکبار در 2 سال اول درمان و متعاقباً هر 6 ماه تا پایان آزمایش ارزیابی شدند. بهبود RFS در گروه PEG-IFN alfa-2b در مقایسه با گروه مشاهده مشاهده شد (نسبت خطر 0.82 [95% CI: 0.71, 0.96]؛ رتبه لگاریتمی طبقهبندی نشده P = 0.011). میانگین RFS تخمینی به ترتیب در گروههای PEG-IFN alfa-2b و مشاهده 34.8 ماه (95% CI: 26.1, 47.4) و 25.5 ماه (95% CI: 19.6, 30.8) بود. با این حال، هیچ تفاوتی در بقای کلی بین دو گروه مشاهده نشد (نسبت خطر 0.98 [95% CI: 0.82, 1.16]). در مجموع ۳۳٪ از بیمارانی که PEG-IFN alfa-2b دریافت میکردند، به دلیل عوارض جانبی، درمان را قطع کردند. شایعترین عوارض جانبی موجود در زمان قطع درمان، خستگی، افسردگی، بیاشتهایی، افزایش ALT، افزایش AST، درد عضلانی، حالت تهوع، سردرد و تب بود.
محاصره نقاط کنترل ایمنی
استفاده از مسدود کردن نقاط کنترل ایمنی از طریق آنتیبادیهای مونوکلونال که ضد CTLA4 (ipilimumab; Yervoy) را هدف قرار میدهند، از سال ۲۰۱۱ به عنوان یک درمان مؤثر برای بیماری مرحله IV شناخته شده است. با این حال، استفاده از آن در شرایط کمکی، یک بررسی بالینی جدیدتر است. اگرچه در سال ۲۰۱۵ برای استفاده در شرایط کمکی بر اساس نتایج EORTC 18071 تأیید شد، اما هنوز بحثهای زیادی در مورد هزینه در مقابل فایده این رژیم درمانی بین پزشکان وجود دارد. یک کارآزمایی تصادفی فاز III بزرگ (EORTC 18071) که دوز بالای ایپیلیموماب را با دارونما در 951 بیمار مقایسه کرد، کاهش قابل توجهی در میزان عود (RFS 5 ساله 40.8٪ در مقابل 30.3٪، نسبت خطر [HR] 0.76، 95٪ CI 0.64 تا 0.89) و بهبود بقای کلی (OS 5 ساله 65.4٪ در مقابل 54.4٪، HR 0.72، 95٪ CI 0.58 تا 0.88، P = 0.001) نشان داد و تا حد زیادی مسئول تأیید بعدی آن در این شرایط بود. ایپیلیموماب با دوز 10 میلیگرم بر کیلوگرم هر 3 هفته یکبار برای چهار دوز، سپس هر 3 ماه یکبار به مدت 3 سال تجویز شد، مگر اینکه سمیت یا عود مانع از ادامه آن میشد.
در ابتدا دارونما تجویز شد، مخالفان این رویکرد در مورد سمیت، افزایش دوز متناقض مشاهده شده در شرایط کمکی در مقایسه با بیماری متاستاتیک (که در مورد دوم از دوز 3 میلیگرم بر کیلوگرم هر 3 هفته × چهار دوز استفاده میشود) و عدم مقایسه رو در رو با اینترفرون اظهار نظر میکنند. سمیت حاصل از کارآزمایی EORTC 18071 ناچیز نبود؛ عوارض جانبی با هر درجهای در 18898.7٪ از بیماران تحت درمان با ایپیلیموماب مشاهده شد، از جمله 54.1٪ با درجه 3 یا 4. میانگین تعداد دوزهای ایپیلیموماب چهار بود. علاوه بر این، پنج مورد مرگ مرتبط با درمان در بیماران تحت درمان با ایپیلیموماب وجود داشت (سه مورد به دلیل کولیت، یک مورد به دلیل میوکاردیت و یک مورد به دلیل نارسایی چند عضوی مرتبط با سندرم گیلن باره). در حالی که ممکن است در هر کارآزمایی بالینی با مرگهای مرتبط با درمان مواجه شویم، چنین رویدادهایی در شرایط کمکی باعث ایجاد احتیاط میشود. برخی استدلال میکنند که آیا سمیت ارزش مزیت بالقوه بقا را دارد یا خیر. این موضوع مرتبط است زیرا کسری از بیماران وجود دارند که هرگز عود نمیکنند و بنابراین هیچ پتانسیلی برای بهرهمندی از هیچ درمان کمکی ندارند. البته، چالش این است که در حال حاضر نمیتوان در سطح یک بیمار خاص این موضوع را دانست. بنابراین، توانایی شناسایی آیندهنگر بیماران پرخطر و کمخطر با نشانگرهای زیستی، حوزهای مورد علاقه مداوم است.
یکی دیگر از کارآزماییهای بالینی تصادفی فاز III در حال انجام در شرایط کمکی (ملانوم IV، مراحل IIIB، IIIC یا IV نسخه هفتم AJCC) ایپیلیموماب را در یکی از دو سطح دوز (یعنی دوز 10 میلیگرم بر کیلوگرم مورد استفاده در EORTC 18071 یا دوز استاندارد 3 میلیگرم بر کیلوگرم که برای بیماران مبتلا به بیماری غیرقابل جراحی/متاستاتیک تأیید شده است) با دوز بالای IFN alfa-2b (ECOG E1609، NCT01274338) مقایسه میکند. نقاط پایانی اصلی مشترک شامل بقای کلی و بقای بدون عود (RFS) است. نتایج موقت، سمیت قابل توجهی بیشتر مرتبط با دوز 10 میلیگرم بر کیلوگرم در مقایسه با 3 میلیگرم بر کیلوگرم را نشان دادهاند. تجزیه و تحلیل RFS برنامهریزی نشده از بیماران تصادفی همزمان در دو گروه ایپیلیموماب، هیچ تفاوتی در RFS در پیگیری متوسط 3.1 سال نشان نداد. اخیراً، محور PD-1 انسداد نقاط بازرسی در شرایط کمکی با استفاده از آنتیبادی مونوکلونال ضد PD-1 نیوولوماب بررسی شد.
در بیماران مبتلا به ملانوم مرحله IV، درمان با نیوولوماب با مشخصات سمیت مطلوبتر و میزان پاسخ بهبود یافته در مقایسه با ایپیلیموماب همراه بوده است. در یک کارآزمایی بالینی تصادفی، دوسوکور، فاز 3 (CheckMate 238) برای بیماران مبتلا به ملانوم پیشرفته برداشته شده، بیش از 900 بیمار که تحت عمل جراحی برداشتن کامل ملانوم مرحله IIIB، IIIC یا IV قرار گرفتند، نیوولوماب (3 میلیگرم بر کیلوگرم هر 2 هفته) یا ایپیلیموماب (10 میلیگرم بر کیلوگرم هر 3 هفته × 4 دوز و سپس هر 12 هفته) دریافت کردند. در حداقل پیگیری 18 ماهه، RFS 12 ماهه در گروه نیوولوماب 70.5٪ (فاصله اطمینان 95٪ [CI]، 66.1 تا 74.5) و در گروه ایپیلیموماب 60.8٪ (فاصله اطمینان 95٪، 56.0 تا 65.2) بود (نسبت خطر [HR] برای عود بیماری یا مرگ، 0.65؛ 97.56٪ CI، 0.51 تا 0.83؛ P < 0.001). سمیت (عوارض جانبی درجه ۳ یا ۴) در ۱۴.۴٪ از بیماران گروه نیوولوماب در مقابل ۴۵.۹٪ از بیماران گروه ایپیلیموماب گزارش شد. علاوه بر این، دو مورد مرگ (۰.۴٪) گزارش شد که مربوط به اثرات سمی در گروه ایپیلیموماب بود. وبر و همکارانش نتیجه گرفتند که نیوولوماب منجر به RFS به طور قابل توجهی طولانیتر و میزان کمتری از عوارض جانبی درجه ۳ یا ۴ نسبت به درمان کمکی با ایپیلیموماب میشود. پیشبینی میشود که نیوولوماب در آینده نزدیک در شرایط کمکی توسط FDA تأیید شود.
درمان هدفمند
مهار دوگانه هدفمند BRAF و MEK (BRAFi/MEKi) در ملانوم جهشیافته BRAFV600 با پاسخ نسبتاً سریع، میزان بالای کنترل بیماری و افزایش بقا در ملانوم مرحله IV همراه بوده است. متأسفانه، این رویکرد همچنین با دوام محدود پاسخ همراه بوده است، که منجر به بررسی مراحل جایگزین بیماری برای این رژیم درمانی شده است. لانگ و همکارانش اثربخشی این عوامل را در مرحله سوم درمان کمکی در یک کارآزمایی تصادفی، دوسوکور و کنترلشده با دارونما، فاز 3 (COMBI-AD) که اخیراً منتشر شده است، بررسی کردند. در این کارآزمایی، بیماران مبتلا به ملانوم مرحله III کاملاً برداشتهشده و جهشهای BRAFV600 (N = 870) به طور تصادفی برای دریافت دابرافنیب خوراکی (150 میلیگرم دو بار در روز) به همراه ترامتینیب (2 میلیگرم یک بار در روز) در مقابل دارونما به روش 1:1 قرار گرفتند. در یک پیگیری متوسط 2.8 ساله، میزان RFS تخمینی 3 ساله در گروه درمان ترکیبی 58٪ و در گروه دارونما 39٪ بود (HR برای عود یا مرگ، 0.47؛ 95٪ CI، 0.39 تا 0.58؛ P < 0.001). علاوه بر این، گروه BRAFi/MEKi بقای کلی (OS) 3 ساله به طور قابل توجهی بالاتر از 86٪ در مقابل 77٪ در گروه دارونما داشت (HR برای مرگ، 0.57؛ 95% CI، 0.42 تا 0.79؛ P = 0.0006)؛ نویسندگان خاطرنشان کردند که این سطح از بهبود از مرز از پیش تعیین شده تجزیه و تحلیل موقت P = 0.000019 عبور نکرده است. آنها نتیجه گرفتند که ترکیب دابرافنیب به همراه ترامتینیب در شرایط کمکی منجر به کاهش قابل توجه خطر عود در بیماران مبتلا به ملانوم مرحله III با جهشهای BRAFV600 و با مشخصات سمیت قابل قبول میشود.
شیمیدرمانی
هیچ مطالعهای اثربخشی درمان کمکی را در بیماران مبتلا به ملانوما که در معرض خطر بالای عود بیماری هستند، نشان نداده است. برعکس، یک کارآزمایی تصادفی از داکاربازین کمکی در مقابل عدم درمان، کاهش آماری معنیداری را در بقا در گروه درمان کمکی نشان داد. شیمیدرمانی کمکی فقط باید در چارچوب یک کارآزمایی بالینی در نظر گرفته شود.
مدیریت عود موضعی
عود موضعی واقعی به عنوان عود در محل تومور اولیه، در داخل یا در امتداد اسکار تعریف میشود و به احتمال زیاد نتیجه برداشت ناقص تومور اولیه است؛ این یک الگوی نسبتاً نادر از عود را نشان میدهد. در بسیاری از موارد، چنین “عودهای موضعی” ممکن است به طور مناسبتری به عنوان تداوم تومور اولیه در نظر گرفته شوند. عود موضعی متشکل از یک ضایعه واحد در بیماری که ملانوم اولیه او ویژگیهای پیشآگهی مطلوبی داشته است، ممکن است به طور مناسب با برداشت وسیع مشابه ضایعه ملانوم اولیه درمان شود. بیمارانی که عود موضعی متشکل از ضایعات متعدد، کوچک و سطحی دارند، ممکن است به روشی مشابه با روشی که برای درمان بیماران مبتلا به بیماری در حال انتقال استفاده میشود (به بالا مراجعه کنید) درمان شوند.
مدیریت بیماری متاستاتیک دوردست
محلهای رایج متاستاز دوردست در بیماران مبتلا به ملانوما، به ترتیب کاهش فراوانی، پوست و بافتهای زیر جلدی (40٪)، ریهها (12٪ تا 36٪)، کبد و مغز هستند. از نظر تاریخی، بیماران مبتلا به متاستازهای سیستمیک پیشآگهی ضعیفی داشتهاند و میانگین بقای آنها از 6 تا 12 ماه متغیر بوده است.
با این حال، در پی درمانهای سیستمیک مؤثر و بادوام (به بخشهای ایمونوتراپی و درمان هدفمند مراجعه کنید)، دستورالعملهای کلی برای انتخاب روشهای درمانی همچنان در حال تکامل هستند. اگرچه بیماری متاستاتیک دوردست همچنان پیشآگهی ضعیفتری را نشان میدهد، اما در طول دهه گذشته پیشرفتهای چشمگیری در میزان بقا برای این گروه مشاهده شده است.
نشان داده شده است که ترکیب برخی از مهارکنندههای ایست بازرسی ایمنی (ایپیلیموماب و نیوولوماب) در ابتدا بقای 1 ساله را از 30٪ به 35٪ در سال 1990 به تقریباً 85٪ افزایش میدهد. این روند همچنان در حال بهبود است و میزان بقای 2 ساله و حتی 5 ساله به ترتیب 63.8٪ و 34٪ در جمعیتهای خاصی از بیماران تحت درمان با رژیمهای مختلف ایمونوتراپی است. به روشهای خاصی، برخی از بیماران مبتلا به بیماری مرحله IV به عنوان بیماران مبتلا به بیماری مزمن در مقابل بیماری لاعلاج درمان میشوند.
بسته به عملکرد و وضعیت بیماری، برنامههای درمانی در این حوزه بر رویکرد «بهترین گزینه بعدی» متمرکز شدهاند. با توجه به این نکته، پزشک و بیمار اکنون گزینههای درمانی متنوعی برای استفاده در صورت نیاز دارند. این گزینهها شامل متاستازکتومی جراحی (درمانبخش یا تسکینی)، درمان سیستمیک ایمنی و/یا هدفمند، استفاده گاه به گاه از شیمیدرمانی مرسوم، درمان داخل ضایعهای، استراتژیهای ترکیبی و همچنین بررسی عوامل و رویکردهای جدید است. بنابراین، کارآزماییهای بالینی یک گزینه قوی و مهم برای بسیاری از بیمارانی هستند که در آنها متاستازهای دوردست تشخیص داده میشوند، زیرا پزشکان نتایج را برای بیماران مبتلا به ملانوم پیشرفته ادامه میدهند.
جراحی
متاستازکتومی کامل ممکن است در بیمارانی که این گزینه به عنوان بخشی از یک رویکرد چند رشتهای برای بیمار مبتلا به متاستاز دوردست در نظر گرفته میشود، در نظر گرفته شود. در بیماران مرحله IV که تحت متاستازکتومی کامل به عنوان بخشی از یک کارآزمایی بالینی کمکی مرحله IV (کارآزمایی فاز III کانواکسین) قرار گرفتند، بقای 5 ساله 40٪ قابل توجه بود. چندین کارآزمایی غیر تصادفی نتایج مشابهی را پس از برداشتن کامل تمام متاستازهای آشکار نشان دادهاند. انتخاب بیمار برای استراتژی متاستازکتومی کامل جراحی بسیار مهم است. از بیش از ۴۲۲۹ بیمار در مرکز سرطان جان وین با ملانوم مرحله IV، ۳۳.۶٪ تحت عمل جراحی برداشتن تومور قرار گرفتند. میزان بقای کلی ۵ ساله برای این گروه ۱۶٪ بود، در حالی که این میزان برای کسانی که تحت عمل جراحی قرار نگرفتند ۷٪ بود. برای کمک به انتخاب بیمار، ارزیابی تصویربرداری کامل، از جمله MRI مغز و CT یا PET/CT قفسه سینه، شکم و لگن پیشنهاد میشود. عوامل مربوط به بیمار نیز در انتخاب نقش دارند.
بیماران نباید بیماریهای همراه داشته باشند که مانع از بهبودی کامل احتمالی پس از جراحی در عرض ۴ تا ۸ هفته شود تا امکان شروع درمانهای کمکی یا سیستمیک فراهم شود. در نهایت، زیستشناسی خود بدخیمی باید در نظر گرفته شود: بیمارانی که متاستاز دوردست آنها پس از یک دوره طولانیتر بدون بیماری ایجاد شده است یا افرادی که با بیماری ایزوله یا الیگومتاستاتیک مراجعه میکنند، به طور کلی بیشتر احتمال دارد که برای برداشتن تومور با جراحی در نظر گرفته شوند. جراحی همچنین میتواند تسکین مؤثری برای متاستازهای دوردستِ ایزوله یا الیگومتاستاتیکِ قابل دسترس ارائه دهد. نمونههایی از ضایعات قابل دسترس شامل متاستازهای احشایی ایزوله، متاستازهای مغزی ایزوله و گاهی اوقات متاستازهای ریوی ایزوله است. استراتژیهای تسکینی ممکن است وضعیت عملکردی را بهبود بخشیده و بیماران را بیشتر به تحمل درمانهای سیستمیک ترغیب کند.
ضایعات ایجادکننده انسداد دستگاه گوارش
انسداد دستگاه گوارش ناشی از ملانوم متاستاتیک معمولاً به دلیل ضایعاتی است که به صورت مکانیکی روده را مسدود میکنند یا به عنوان نقطه شروع برای درهمرفتگی روده عمل میکنند. این ضایعات زیرمخاطی معمولاً با برداشتن روده برداشته میشوند. بیماران همچنین باید برای احتمال ایلئوستومی یا کولوستومی آماده باشند.
متاستازهای ریوی
پس از متاستازهای زیرجلدی، ریهها شایعترین محل بعدی متاستازهای ملانوم دوردست هستند. میزان بقای ۱ ساله در این بیماران حدود ۵۰٪ گزارش شده است. ارزش برداشتن ریه برای متاستازهای ملانوما بحثبرانگیز است. در مطالعهای که ۶۵ مورد برداشتن ریه انجام شده برای متاستازهای ریوی که از نظر بافتشناسی ثابت شده بودند و پس از درمان ملانوما اولیه کشف شده بودند را بررسی کرد، میزان بقای آماری پس از توراکوتومی در ۵ سال ۲۵٪ بود (میانگین فاصله از برداشتن ریه تا مرگ، ۱۸ ماه). بیمارانی که قبل از توراکوتومی متاستازهای گرهای منطقهای نداشتند، میانگین بقای ۳۰ ماه داشتند، در حالی که این میزان برای سایر بیماران ۱۶ ماه بود. نویسندگان نتیجه گرفتند که بیمارانی که متاستازهای ریوی جدا شده از ملانوما دارند، ممکن است از برداشتن آن متاستازها سود ببرند. با این حال، بسیاری از بیماران مبتلا به بیماری مرحله IV در زمان تشخیص مرحله IV قابل برداشتن نیستند. مطالعهای بر روی بیمارانی که با متاستاز ریوی ملانوما مراجعه کرده بودند، نشان داد که تنها ۲۱٪ در زمان تشخیص قابل برداشتن بودند. با این حال، یک ارزیابی گذشتهنگر از ثبت بینالمللی متاستازهای ریه نشان داد که بیماران مبتلا به ملانوما که تحت عمل جراحی متاستازکتومی کامل ریوی قرار گرفتند، میزان بقای 5 ساله 22٪ داشتند.
متاستازهای کبدی
تقریباً 15 تا 20 درصد از بیماران مبتلا به ملانوما متاستاتیک دوردست، متاستاز کبدی دارند. از نظر تاریخی، میانگین بقای بیماران مبتلا به متاستاز کبدی از 2 تا 7 ماه متغیر بوده است. برخی از محققان اظهار داشتهاند که برداشتن متاستاز کبدی به دلیل پیشآگهی نامطلوب مرتبط، ضروری نیست. سایر محققان اظهار داشتهاند که برداشتن تومور ممکن است فقط در بیمارانی که تومور اولیه چشمی دارند مناسب باشد، زیرا سیر بالینی آنها بهتر از بیماران مبتلا به متاستاز کبدی ناشی از تومورهای اولیه پوستی است. در یک سری چند مرکزی گذشتهنگر از 40 بیمار که تحت عمل جراحی برداشتن متاستاز کبدی ناشی از ملانوما قرار گرفتند، 75٪ از بیماران دچار عود بعدی شدند. بیماران مبتلا به ملانوم پوستی به طور قابل توجهی بیشتر احتمال عود مجدد بیماری در خارج از کبد را داشتند که نشان میدهد بیماری در زمان برداشتن کبد سیستمیک است. هیچ بیماری با ملانوم پوستی متاستاتیک به کبد تا 5 سال زنده نماند. بنابراین، انتخاب بیماران برای برداشتن متاستازهای کبدی باید فردی باشد و شامل ارزیابی گسترده از وسعت بیماری باشد. در مطالعهای از موسسه سرطان جان وین و واحد ملانوم سیدنی (N = 1750 بیمار مبتلا به ملانوم با بیماری کبدی)، تنها 2٪ کاندید برداشتن کبد بودند. بقای 5 ساله در گروه برداشته شده (کامل یا ناقص) 29٪ در مقابل 4٪ برای کسانی بود که تحت عمل جراحی قرار نگرفتند. به طور مشابه، یک مطالعه چند نهادی که شامل مرکز سرطان MD Anderson، مرکز پزشکی دانشگاه دوک و مراکزی در فرانسه و ایتالیا بود، میانگین بقای 23.6 ماه را در این بیماران بسیار انتخاب شده که تحت عمل جراحی قرار گرفتند، نشان داد. همانند سایر محلهای متاستاز، برداشتن تومور باید تنها به عنوان بخشی از یک رویکرد تیمی چند رشتهای در نظر گرفته شود.
متاستازهای مغزی
ملانوما پس از کارسینوم سلول کوچک ریه، شایعترین توموری است که به مغز متاستاز میدهد. یکی از ویژگیهای غیرمعمول متاستازهای مغزی، تمایل آنها به خونریزی است که در ملانوما بسیار بیشتر از سایر تومورهای اولیه رخ میدهد. خونریزی در ۳۳ تا ۵۰ درصد از بیماران مبتلا به متاستاز مغزی ناشی از ملانوما رخ میدهد. پیشآگهی با افزایش تعداد ضایعات و وجود علائم عصبی بدتر میشود؛ میانگین بقای بیماران از نظر تاریخی ۳ تا ۴ ماه گزارش شده است.
برداشتن تومور به روش جراحی (و به دنبال آن در موارد منتخب، پرتودرمانی جمجمه) معمولاً درمان انتخابی در مورد متاستاز مغزی منفرد و قابل دسترسی از نظر جراحی است. برداشتن تومور نسبتاً بیخطر است، علائم را در اکثر بیماران کاهش میدهد و از آسیب عصبی بیشتر جلوگیری میکند. اگرچه بقای طولانی مدت بدون بیماری غیرمعمول است، اما به ندرت پیش میآید که یک بیمار بیش از 5 سال پس از جراحی زنده بماند. پرتودرمانی زمانی ترجیح داده میشود که ضایعات متعدد باشند یا در مناطقی قرار داشته باشند که مانع از عمل جراحی ایمن شوند. رادیوجراحی استریوتاکتیک همچنین گزینه مهمی برای بیمارانی با متاستازهای مغزی کوچک تا متوسط است که امید به زندگی معقولی دارند و هیچ نشانهای از افزایش فشار داخل جمجمه ندارند. برای بیمارانی با متاستازهای متعدد که قابل برداشتن نیستند، پرتودرمانی کل مغز ممکن است به کاهش رشد متاستازها کمک کند، اگرچه استفاده از آن در برخی از محافل بالینی بحثبرانگیز است.
متاستازهای دوردست عودکننده
متاسفانه، بسیاری از بیمارانی که تحت عمل جراحی کامل برداشتن ملانوم متاستاتیک دوردست (مرحله IV) قرار میگیرند، دچار بیماری عودکننده میشوند. در مطالعهای که قبل از موج اخیر درمانهای سیستمیک مورد تایید FDA برای ملانوم پیشرفته انجام شد، محققان بررسی کردند که آیا متاستازکتومی دوم میتواند بقای بیماران مبتلا به ملانوم عودکننده مرحله IV را طولانیتر کند یا خیر. در این مطالعه، بیماری عودکننده بافت نرم، ریه، دستگاه گوارش، مغز، اسکلت و اندامهای زنان را تحت تأثیر قرار داد. میانگین بقای پس از درمان برای ملانوم عودکننده مرحله IV، پس از متاستازکتومی کامل، 18.2 ماه بود، در حالی که این میزان پس از عمل جراحی تسکینی 12.5 ماه و پس از درمان غیرجراحی 5.9 ماه بود. میزان بقای 5 ساله برای بیماران گروه متاستازکتومی کامل 20٪ بود، در حالی که این میزان برای بیماران گروه جراحی تسکینی 7٪ و برای بیماران گروه غیرجراحی 2٪ بود. با تجزیه و تحلیل چند متغیره، دو عامل مهم پیشآگهی برای بقا پس از تشخیص ملانوم عودکننده مرحله IV، یک دوره طولانی بدون بیماری قبل از عود و برداشتن کامل بیماری عودکننده با جراحی بود. این یافتهها نشان میدهد که در یک جمعیت بسیار انتخابی از بیماران، متاستازکتومی میتواند بقای بیماران مبتلا به ملانوم عودکننده مرحله IV را طولانیتر کند و در صورت برداشتن تمام تومورهای بالینی مشهود، میتواند در چارچوب مدیریت تیمی چندرشتهای در نظر گرفته شود.
درمان هدفمند
درمان هدفمند از مفهوم اختصاصی بودن در حوزه درمان سرطان بهره میبرد. این داروها شامل مهارکنندههای کیناز هستند که بر روی یک هدف (یا اهداف) مولکولی خاص عمل میکنند و در نتیجه مسیرهای تکثیر سلولی دخیل در توسعه و تکثیر تومور را مختل میکنند. با توجه به سابقهی ثبتشدهای که توسط سایر بدخیمیها، مانند سرطان پستان (تراستوزوماب) و لوسمی/GIST (ایماتینیب)، ملانوما در میانه یک تغییر الگو در درمان سرطان است. شایان ذکر است که تا به امروز، تمام عوامل درمان هدفمند مورد استفاده برای درمان ملانوما این مزیت را دارند که میتوانند به صورت خوراکی تجویز شوند. با توجه به سهولت تجویز و کنترل اغلب عمیق بیماری که با این عوامل مشاهده میشود (به زیر مراجعه کنید)، روش ما در MD Anderson این است که به طور معمول تومورهای بیماران مبتلا به بیماری متاستاتیک را از نظر مولکولی مشخص کنیم تا گزینههای درمانی درمان هدفمند بتوانند در یک استراتژی درمانی کلی ادغام شوند.
مهارکنندههای BRAF
در طول دهه گذشته، توجه به سمت استفاده از درک بهبود یافته ما از زیستشناسی مولکولی زمینهای ملانوما با استفاده از چنین اطلاعاتی برای توسعه درمانهای هدفمند بالقوه با مسیر خاص به عنوان یک درمان بالقوه برای بیماران مبتلا به ملانوما متاستاتیک معطوف شده است. یک نمونه مهم از این رویکرد، توسعه درمانهای جدید است که BRAF جهشیافته (V600E) را در ملانوم متاستاتیک هدف قرار میدهند. ژن BRAF کدکننده تولید B-RAF، پروتئینی است که در سیگنالینگ سلولی و رشد نقش دارد. جهشهای BRAF در تقریباً 50٪ از ملانومهای پوستی تهاجمی یافت شدهاند. BRIM-3 یک مطالعه تصادفی، برچسب باز، چند مرکزی و فاز III است که یک مهارکننده BRAF، PLX4032 (vemurafenib)، را با داکاربازین برای درمان ملانومای مرحله IIIC یا مرحله IV که قبلاً درمان نشده، غیرقابل جراحی، در بیمارانی که دارای جهش BRAF هستند، مقایسه میکند. این مهارکننده جهش رایج V600E BRAF را هدف قرار میدهد. تجزیه و تحلیل موقت 675 بیمار، برتری در بقای کلی و بقای بدون پیشرفت (OS) برای ومورافنیب را نشان داد. میزان پاسخ بیماران مصرفکننده ومورافنیب 48.4٪ در مقایسه با 5.5٪ برای بیمارانی بود که داکاربازین دریافت میکردند. اگرچه چنین میزان پاسخی برای درمان تکروشی اساساً در درمان ملانوم متاستاتیک بیسابقه بود، اما شور و شوق، حداقل تا حدی، با مشاهده عود بیماری در اکثر بیماران ۶ تا ۸ ماه پس از شروع درمان، کاهش یافت. همچنین مشاهده این نکته مهم بود که تا ۲۵٪ از بیمارانی که ومورافنیب دریافت کردند، به کارسینوم سنگفرشی پوست، اغلب به شکل کراتوآکانتوماس، مبتلا شدند.
دابرافنیب (گلاکسواسمیتکلاین)، عامل دیگری که ملانوم جهشیافته BRAF V600 را هدف قرار میدهد، میزان OR بالایی را در یک کارآزمایی فاز III نشان داد. در مجموع، این یافتهها مبنایی برای تأیید هر یک از این عوامل به عنوان مونوتراپی به ترتیب در سالهای ۲۰۱۱ و ۲۰۱۳ فراهم کرد.
MEK، یک کیناز پاییندست RAF در مسیر MAPK، به روشی مشابه هدف قرار گرفته است. مهارکنندههای MEK همچنین به عنوان مونوتراپی در بیماران مبتلا به ملانوم متاستاتیک با جهش BRAF مفید نشان دادند که منجر به تأیید ترامتینیب توسط FDA در سال ۲۰۱۳ شد. شایان ذکر است که مهارکنندههای MEK به ندرت به عنوان مونوتراپی برای بیماران مبتلا به ملانوم متاستاتیک با جهش BRAF استفاده میشوند.
شناسایی مکانیسمهای مقاومت، بخش فعالی از تحقیقات معاصر ملانوم را تشکیل میدهد که هدف آن شناسایی رویکردهای ترکیبی بالقوهای است که ممکن است مسیرهای مقاومت را کاهش داده و پاسخ پایدار را ارتقا دهند. مطالعات متعددی مکانیسمهای اکتسابی مقاومت درمانی به درمان هدفمند BRAF را روشن کردهاند و بینشهای به دست آمده منجر به استراتژیهای درمانی برای افزایش پاسخ به درمان شده است. نتیجه این امر، استفاده از مهار ترکیبی BRAF و MEK است – بر اساس این مشاهده که اکثر ملانومهای جهش یافته BRAF در زمان مقاومت درمانی، فعال شدن مجدد مسیر MAPK را نشان میدهند.
این ترکیب در کارآزماییهای بالینی روی بیماران بستری مبتلا به ملانوم جهشیافته BRAF آزمایش شد و نتایج نشان داد که درمان با مهار ترکیبی BRAF و MEK (به عنوان مثال، دابرافنیب به همراه ترامتینیب در مقابل مونوتراپی دابرافنیب) با پاسخ کلی بالاتر (76٪ در مقابل 54. برافنیب و ترامتینیب برای استفاده ترکیبی در بیماران مبتلا به ملانوم جهشیافته BRAF غیرقابل جراحی یا متاستاتیک) همراه بود. سال بعد، FDA همچنین ترکیب مهارکننده BRAF/MEK شامل ومورافنیب و کوبیمتینیب را تأیید کرد. لازم به ذکر است که نشان داده شده است که مهارکنندههای BRAF به طور متناقضی رشد را در بیماران با وضعیت BRAF نوع وحشی تحریک میکنند. دادههای اخیراً منتشر شده از کارآزمایی بالینی COMBI-MB که بیماران مبتلا به متاستازهای مغزی ملانوم را برای دریافت دابرافنیب و ترامتینیب ثبتنام کرده بود؛ در چهار گروه بیمار، پاسخ داخل جمجمهای از 44٪ تا 59٪ متغیر بود، اگرچه مدت زمان پاسخ نسبتاً کوتاه بود.
مهارکنندههای KIT
جهشهای KIT یکی دیگر از اهداف درمانی بودهاند. برای بیماران مبتلا به ملانوم متاستاتیک. چندین گزارش موردی، سودمندی این دارو را برای بیمارانی که با مهارکننده KIT درمان شده بودند، نشان داده بود. کارواجال و همکارانش نتایج یک مطالعه فاز II روی 28 بیمار مبتلا به ملانوم متاستاتیک غیرقابل جراحی که جهشهای KIT داشتند و با ایماتینیب مزیلات درمان شده بودند، منتشر کردند. در این مطالعه، 16٪ از بیماران پاسخهای پایداری داشتند که بیش از یک سال طول کشید. در حال حاضر، تعدادی از آزمایشهای بالینی در حال بررسی هدف قرار دادن هر دو جهش KIT و NRAS هستند.
ایمونوتراپی
ایمونوتراپی را میتوان به طور کلی به عنوان درمانی توصیف کرد که پاسخ ایمنی سلولی میزبان به سرطان را افزایش میدهد. تا به امروز، گزینههای موجود شامل عواملی هستند که (1) تکثیر عمومی، البته غیر اختصاصی سیستم ایمنی (دوز بالای IL-2)، (2) کاهش بسیار اختصاصی تنظیمکنندههای مهارکننده نظارت بر تومور (مسدود کردن نقاط بازرسی ایمنی)، (3) تکثیر آزمایشگاهی و انتقال بعدی سلولهای ایمنی اتولوگ (درمان سلولی تطبیقی [ACT])، یا (4) ترکیبی از هر یک از موارد زیر را افزایش میدهند: بالا.
اینترلوکین-۲
اینترلوکین-۲ (IL-۲) تکثیر، تمایز و جذب سلولهای T، B و NK را افزایش میدهد و فعالیت سیتولیتیک را در زیرمجموعهای از لنفوسیتها آغاز میکند. اگرچه دوز بالای IL-۲ در بیماران منتخب مناسب، میزان پاسخ کلی تنها ۱۰٪ تا ۱۵٪ دارد، اما عموماً در میان کسری از بیمارانی که پاسخ کامل دارند، پایدار است. چنین پایداری پاسخی با تأیید FDA ایالات متحده برای ملانوم متاستاتیک در سال ۱۹۹۸ مرتبط بود. با این حال، تجویز IL-۲ با عوارض جانبی متعددی همراه است، از جمله، اما نه محدود به “سندرم نشت مویرگی” نادر اما بالقوه تهدیدکننده زندگی. بنابراین، باید فقط توسط پزشکان و تیمهای باتجربه در مدیریت چنین درمانهایی تجویز شود.
محاصره ایست بازرسی ایمنی
ایپیلیموماب یک آنتیبادی مونوکلونال انسانی است که CTLA-۴، یک مولکول تنظیمی کلیدی سیستم ایمنی، را مسدود میکند. در یک کارآزمایی آیندهنگر تصادفی فاز III، هودی و همکارانش ۶۷۶ بیمار را که دریافت کرده بودند، ارزیابی کردند. ایپیلیموماب، ایپیلیموماب به همراه واکسن پپتیدی، یا واکسن پپتیدی به تنهایی.
پاسخ کلی و کنترل بیماری در گروه ایپیلیموماب به تنهایی بیشترین بود. میانگین بقای کلی برای این گروه 10.1 ماه و پاسخ کلی 10.9٪ بود. کنترل بیماری 28.5٪ بود و 60٪ از گروه ایپیلیموماب در 2 سال پاسخ قابل توجهی داشتند.
در مارس 2011، سازمان غذا و داروی آمریکا (FDA) ایپیلیموماب را به عنوان درمان خط دوم برای ملانوم متاستاتیک تأیید کرد. یک مطالعه جدیدتر، مزایای ایپیلیموماب را در شرایط خط اول نشان داد. در یک کارآزمایی بالینی دوسوکور فاز III بر روی 502 بیمار مبتلا به ملانوم متاستاتیک که به صورت تصادفی به دو گروه ایپیلیموماب به همراه داکاربازین در مقابل دارونما به همراه داکاربازین توسط رابرت و همکارانش تقسیم شدند، گروه ایپیلیموماب با بقای کلی به طور قابل توجهی بالاتر (11.2 ماه در مقابل 9.2 ماه) و پاسخ پایدار (19.3 ماه در مقابل …) همراه بود. ۸.۳ ماه).
همانطور که در بخش کمکی بالا ذکر شد، دوز ایپیلیموماب در سطوح و برنامههای مختلفی مورد مطالعه قرار گرفته است. برای بیماران مبتلا به ملانوم متاستاتیک، دوز ایپیلیموماب که در حال حاضر تأیید شده است، ۳ میلیگرم بر کیلوگرم است که به صورت تزریق داخل وریدی هر ۳ هفته یکبار برای چهار دوز تجویز میشود. یک کارآزمایی تصادفی فاز II نشان داد که میزان پاسخ عینی و بقای کلی با افزایش دوز به ۱۰ میلیگرم بر کیلوگرم به تدریج افزایش مییابد. با این حال، عوارض جانبی جدی مرتبط با سیستم ایمنی، از جمله قطع دارو، نیز با افزایش دوز افزایش یافت. دوز ایپیلیموماب در یک کارآزمایی تصادفی فاز III اروپایی با ۷۲۷ بیمار که به صورت تصادفی به ۳ میلیگرم بر کیلوگرم یا ۱۰ میلیگرم بر کیلوگرم تقسیم شده بودند، بیشتر مورد مطالعه قرار گرفت. نتایج اولیه در نشست انجمن اروپایی انکولوژی پزشکی (ESMO) در سال ۲۰۱۶ ارائه شد. بقای کلی با دوز بالاتر ایپیلیموماب به طور قابل توجهی افزایش یافت (OS 3 ساله ۳۱.۲٪ در مقابل ۲۳.۲٪، میانگین ۱۵.۷ در مقابل ۱۱.۵ ماه، HR 0.84، 95% CI 0.70 تا 0.99). همانطور که انتظار میرفت، میزان عوارض جانبی درجه 3 تا 5 و عوارض جانبی مرتبط با سیستم ایمنی با برنامه 10 میلیگرم بر کیلوگرم به طور قابل توجهی بالاتر بود (به ترتیب 34.3٪ در مقابل 18.5٪ و 33.5٪ در مقابل 17.4٪).
محور اصلی بعدی بررسی ایمنی مورد مطالعه، محور پروتئین مرگ سلولی برنامهریزیشده-۱ (PD-1) بود که در محیط پیرامونی برای تعدیل پاسخهای سلولهای T عمل میکند. PD-1 با دو لیگاند که عضو مولکولهای شبه B7 (PD-L1 و PD-L2) هستند، تعامل میکند تا پاسخهای سلولهای T را تعدیل کند و از نظر فیزیولوژیکی برای محدود کردن خودایمنی عمل کند. اثر مهاری PD-1 از طریق مکانیسم دوگانهی ترویج آپوپتوز در سلولهای T سیتوتوکسیک (مرگ سلولی برنامهریزیشده، همانطور که از نامش پیداست) و همزمان کاهش آپوپتوز در سلولهای T تنظیمی (Tregs) انجام میشود. پروتئین PD-1 در سلولهای T فعالشده افزایش مییابد و انسداد این مولکول منجر به فعالیت ضد توموری سیستم ایمنی سلولی با مهار این مکانیسم بازخورد منفی طبیعی میشود.
استفاده بالینی از آنتیبادیهای مسدودکننده PD-1 در چندین کارآزمایی بالینی، از جمله یک کارآزمایی فاز I بر روی ۲۹۶ بیمار مبتلا به ملانوم پیشرفته یا سایر تومورهای جامد، آزمایش شده است. درمان با یک آنتیبادی مونوکلونال که PD-1 را هدف قرار میدهد (نیوولوماب) با میزان پاسخ 28٪ در بیماران مبتلا به ملانوم متاستاتیک همراه بود و پاسخهای طولانیمدت در 50٪ از پاسخدهندگان بیش از 1 سال بود. درمان مبتنی بر ضد PD-1 در مقایسه با ایپیلیموماب با میزان پایینتر عوارض جانبی درجه 3 یا 4 همراه بود. آزمایشهای بالینی بیشتری انجام شده است (NCT01295827/NCT01704287)، از جمله یک آزمایش فاز III با بیش از 500 بیمار مبتلا به ملانوم متاستاتیک که بیماری آنها به مسدود کردن CTLA-4 مقاوم بود. در این آزمایش (KEYNOTE-002)، بیماران به صورت تصادفی به دو گروه پمبرولیزوماب (2 میلیگرم بر کیلوگرم هر 3 هفته)، پمبرولیزوماب (10 میلیگرم بر کیلوگرم هر 3 هفته) یا شیمیدرمانی (کاربوپلاتین به همراه پاکلیتاکسل، پاکلیتاکسل به تنهایی، داکاربازین یا تموزولومید طبق استاندارد نهادی) تقسیم شدند. PFS نقطه پایانی اولیه بود و با هر دو گروه پمبرولیزوماب در مقایسه با شیمیدرمانی به طور قابل توجهی بهبود یافت؛ PFS شش ماهه به ترتیب برای پمبرولیزوماب ۲ میلیگرم بر کیلوگرم، پمبرولیزوماب ۱۰ میلیگرم بر کیلوگرم و شیمیدرمانی ۳۴٪، ۳۸٪ و ۱۶٪ بود.
سمیت در این کارآزمایی محدود بود؛ شایعترین عوارض جانبی شامل خستگی، خارش و بثورات پوستی بود. عوارض جانبی مرتبط با سیستم ایمنی درجه ۳ (IRAE) در دو بیمار تحت درمان با پمبرولیزوماب ۲ میلیگرم بر کیلوگرم (هپاتیت، هیپوفیز) و در هشت بیمار که پمبرولیزوماب ۱۰ میلیگرم بر کیلوگرم دریافت کردند (هپاتیت، کولیت، پنومونیت و التهاب عنبیه یا یووئیت) مشاهده شد.
درمانهای سلولی
درمان سلولی یا سلولدرمانی تطبیقی (ACT) شامل تکثیر و فعالسازی آزمایشگاهی، به تعداد فوق فیزیولوژیکی (1010-12)، سلولهای T سیتوتوکسیک بسیار اختصاصی علیه تومور خود بیمار و تزریق مجدد پس از یک رژیم آمادهسازی لنفودلیزکننده است. این سلولها در ابتدا با برداشتن رسوب متاستاتیک و رشد به اصطلاح TIL به دست میآمدند. اخیراً، این لنفوسیتهای سیتوتوکسیک با اصلاح ژن سلولهای تک هستهای خون محیطی بیمار (PBMCs) یا ایجاد گیرندههای آنتیژن کایمریک (CARs) ایجاد شدهاند که اختصاصیت را بیشتر میکنند و به ضایعه قابل برداشت وابسته نیستند. در موسسه ملی سرطان ایالات متحده (NCI)، روزنبرگ و دیگران تجربیات خود را با ACT با استفاده از TIL که عموماً از تومورهای متاستاتیک مشتق شدهاند، گزارش کردهاند. میزان پاسخ کلی تا 72٪ در بیماران مبتلا به بیماری مرحله IV که با ACT درمان شده بودند، همراه با یک رژیم آمادهسازی گسترده برای کاهش ایمنی (شیمیدرمانی کاهشدهنده لنف + 12 گری تابش کل بدن [TBI]) مشاهده شد. یک مطالعه تصادفی و آیندهنگر توسط همان گروه، نقش TBI اضافه شده را تأیید نکرد، اما با این وجود، میزان پاسخ کلی چشمگیر 56٪ را گزارش کرد. مراحل کلیدی مؤثر بر پاسخ شامل اثربخشی کاهش لنف قبل از انتقال سلول T، منبع خارج گرهای TIL، مدت زمان کوتاه کشت، زمان کوتاه دو برابر شدن TIL، لیز تومور اتولوگ بیشتر توسط TIL و ترشح فاکتور تحریککننده گرانولوسیت-ماکروفاژ توسط TIL است. درمانهای سلولی به دلیل اصلاح ژنتیکی ذکر شده قبلی، بسیار اختصاصیتر میشوند و سمیت “خارج از هدف” بسیار کمتری دارند. شواهد اخیر از NCI نشان میدهد که نئوآنتیژنها و گیرندههای سلول T مربوطه (TCR) آنها را میتوان هم در تومورها (از جمله یووهآی متاستاتیک) و هم در خون محیطی شناسایی کرد. پس از تهیه، میتوان این سلولها را به صورت گسترده در شرایط آزمایشگاهی (in vitro) برای تزریق بعدی تکثیر کرد. رویکردهای دیگری که از تزریق سلولهای دندریتیک پالسی در شرایط آزمایشگاهی (in vitro) استفاده میکنند نیز در حال انجام است. نکته مهم این است که از آنجایی که این تکنیکها نیاز به تخصص تخصصی و زیرساختهای پیشرفته دارند، در حال حاضر فقط در مراکز دانشگاهی منتخب در سراسر جهان در دسترس هستند.
استراتژیهای ترکیبی
با توجه به مکانیسمهای متفاوت عملکرد مسدود کردن CTLA-4 و مسدود کردن PD-1، استفاده ترکیبی از آنها مورد بررسی قرار گرفته است؛ دادههای پیشبالینی و آزمایشهای بالینی، فعالیت ضد توموری افزایشیافتهای را برای رویکرد مبتنی بر ترکیب نشان دادهاند. با این حال، مزیت بالینی با افزایش سمیت همراه است. در بزرگترین آزمایش بالینی فاز III که مهار ایست بازرسی ضد PD-1 و ضد CTLA-4 را ترکیب میکند (CheckMate 067)، بیش از 900 بیمار بدون درمان به طور تصادفی به دو گروه تقسیم شدند: نیوولوماب (1 میلیگرم بر کیلوگرم هر 3 هفته) به علاوه ایپیلیموماب (3 میلیگرم بر کیلوگرم هر 3 هفته) برای چهار دوز و به دنبال آن نیوولوماب (3 میلیگرم بر کیلوگرم هر 2 هفته)، نیوولوماب به تنهایی (3 میلیگرم بر کیلوگرم هر 2 هفته) یا ایپیلیموماب به تنهایی (3 میلیگرم بر کیلوگرم هر 3 هفته برای چهار دوز). اهداف اصلی این آزمایش، بقای بدون پیشرفت (PFS) و بقای کلی (OS) بودند. در یک پیگیری متوسط ۱۲ ماهه، میانگین PFS برای گروه ترکیبی یا گروه نیوولوماب به تنهایی نسبت به ایپیلیموماب به تنهایی برتر بود (به ترتیب ۱۱.۵ در مقابل ۲.۹ ماه و ۶.۹ در مقابل ۲.۹ ماه). جای تعجب نیست که سمیتهای جدی با این ترکیب بیشتر از هر یک از گروههای مونوتراپی به تنهایی بود. علیرغم سمیت و بر اساس دادههای بقا، FDA در سال ۲۰۱۵ برای ترکیب ایپیلیموماب و نیوولوماب برای بیماری مرحله IV، تأیید تسریعشدهای را اعطا کرد. با توجه به سمیتهای مرتبط با این رژیم ترکیبی مهارکننده نقاط کنترل، ترکیبات اضافی در حال بررسی هستند، از جمله ترکیب با سایر مهارکنندههای جدید نقاط کنترل و سایر روشها مانند درمان هدفمند. به عنوان مثال، در کارآزمایی بالینی فاز ۱b KEYNOTE-029، پمبرولیزوماب با دوز استاندارد در ترکیب با ایپیلیموماب با دوز کاهشیافته برای بیماران مبتلا به ملانوم پیشرفته استفاده شد و در مجموع مشخص شد که با مشخصات سمیت قابل کنترل و فعالیت ضد توموری قوی همراه است. مطالعات بیشتری برای تعریف بهتر چنین رژیمهایی در حال انجام است.
واکسنهای تومور
واکسنهای تومور همچنین برای درمان ملانوم پیشرفته و به عنوان درمان کمکی برای بیماران مبتلا به ملانوم پرخطر مورد بررسی قرار گرفتهاند. این واکسنها ممکن است حاوی (1) سلولهای تومور پرتودهی شده باشند که معمولاً از بیمار گرفته میشوند (2) آنتیژنهای ملانوم تا حدی یا کاملاً خالص شده یا (3) غشاهای سلولی تومور از سلولهای ملانوم آلوده به ویروس (انکولیزاتهای ویروسی). واکسنهای مصنوعی حاوی ژنهایی که آنتیژنهای تومور و خود آنتیژنهای پپتیدی را رمزگذاری میکنند نیز در حال ارزیابی هستند، همانطور که واکسنهایی حاوی ژنهایی که پروتئینهای سیگنال کمکتحریککننده ایمنی را رمزگذاری میکنند نیز در حال ارزیابی هستند. واکسنهای سلول توموری آلوژنیک، که عموماً از ردههای سلولی کشتشده یا لیزاتهای آنها تهیه میشوند، چندین مزیت بالقوه مهم نسبت به واکسنهای سلول توموری اتولوگ ارائه میدهند. واکسنهای آلوژنیک به راحتی در دسترس هستند و میتوانند به روشی مشابه هر عامل درمانی دیگر استاندارد، نگهداری و توزیع شوند. تا به امروز، اکثر مطالعات مربوط به واکسنهای توموری آلوژنیک، مطالعات کوچک و تکمؤسسهای بودهاند. هیچ یک از این موارد، مزیت قطعی ایمونوتراپی با سلولهای توموری آلوژنیک تجویز شده همراه با BCG را در مقایسه با عدم درمان یا درمان با BCG به تنهایی نشان ندادهاند.
استراتژیهای واکسن دیگر شامل تجویز پپتیدهای مصنوعی مبتنی بر آنتیژنهای شناخته شده سلول T ملانوم، واکسنهای ژنتیکی و ترکیب واکسنها با سیتوکینها یا مولکولهای کمک محرک است. مورتون و همکارانش مطالعات غیر تصادفی از واکسن چند ظرفیتی ملانوم (کانواکسین) را در بیماران مبتلا به بیماری مرحله III یا مرحله IV انجام دادند. اگرچه تجزیه و تحلیل جفتهای همسان از دادههای حاصل از آزمایشهای فاز 2، مزیت پایدار سیستم ایمنی برای درمان با کانواکسین در ملانوم مرحله III یا مرحله IV را نشان داد، اما دو آزمایش بالینی تصادفی فاز III جداگانه از کانواکسین در بیماران مبتلا به ملانوم مرحله III یا IV، به دلیل عدم وجود مزیت بالقوه بر اساس تجزیه و تحلیلهای موقت، متوقف شدند.
شیمی درمانی
شیمی درمانی تک عاملی از نظر تاریخی یک استاندارد مراقبت برای شیمی درمانی سیستمیک در بیماران مبتلا به ملانوم متاستاتیک بوده است، اما میزان پاسخ همچنان بسیار پایین است. داکاربازین عموماً داروی انتخابی بوده است و میزان پاسخدهی آن ۱۶٪ بوده است. داروهای دیگر، از جمله سیس پلاتین، پاکلیتاکسل، دوستاکسل و آنالوگ داکاربازین، تموزولومید، نیز در این بیماری فعالیت نشان دادهاند. به طور کلی، حتی زمانی که ملانوم متاستاتیک به شیمیدرمانی سیستمیک پاسخ میدهد، مدت زمان پاسخ معمولاً کوتاه است، در محدوده ۳ تا ۶ ماه (همچنین به بیوشیمیدرمانی در زیر مراجعه کنید).
بیوشیمیدرمانی
آزمایشهای متعددی، مزیت بالقوه ترکیب درمان بیولوژیکی با شیمیدرمانی، رویکردی که به عنوان بیوشیمیدرمانی شناخته میشود، را بررسی کردهاند. به طور کلی، اگرچه بیوشیمیدرمانی در چندین آزمایش نسبتاً کوچک با میزان پاسخدهی بالاتر و میانگین بقای طولانیتر نسبت به شیمیدرمانی به تنهایی همراه بود، یک متاآنالیز از شیمیدرمانی در مقابل بیوشیمیدرمانی که در سال ۲۰۰۷ انجام شد، نتیجه گرفت که هیچ مزیتی در هیچ یک از دو گروه از نظر مدت زمان پاسخدهی یا بقای کلی وجود ندارد. با این حال، بیوشیمیدرمانی در به تأخیر انداختن پیشرفت بیماری و در میزان پاسخدهی جزئی یا کامل برتر بود. در حال حاضر، بیوشیمی درمانی اغلب برای بیماران مبتلا به ملانوم متاستاتیک استفاده میشود.
پرتودرمانی
برداشتن گسترده تومور، درمان استاندارد برای ملانوم اولیه است، اما گاهی اوقات پرتودرمانی در بیمارانی که به دلایل مختلف (مثلاً بیماریهای شدید پزشکی) غیرقابل جراحی تشخیص داده شدهاند، انجام شده است. در یک مطالعه روی ۹۵ ملانوم تهاجمی که با دوز بالای پرتودرمانی درمان شدهاند، میزان بقای ۵ ساله ۷۰٪ بوده است. در مواردی که میزان عود موضعی بالا است (مثلاً عدم توانایی در به دست آوردن حاشیههای کافی، ملانوم دسموپلاستیک)، پرتودرمانی کمکی به محل اولیه مورد توجه قرار میگیرد.
نقش پرتودرمانی کمکی به حوضههای غدد لنفاوی منطقهای نیز بررسی شده است. چندین مطالعه گذشتهنگر نشان دادهاند که حوضههای غدد لنفاوی با چندین گره درگیر تومور، یک یا چند گره لنفاوی متاستاتیک با قطر بیش از 3 سانتیمتر، گسترش خارج کپسولی یا بیماری منطقهای عودکننده ممکن است از پرتودرمانی کمکی بهرهمند شوند، اگرچه سمیت ناشی از این رویکرد، شور و شوق را کاهش داده است، به ویژه برای بیمارانی که پرتودرمانی به کشاله ران در آنها در نظر گرفته شده است. نکته مهم این است که یک کارآزمایی تصادفی کنترلشده از استرالیا، 234 بیمار را که در معرض خطر بالای عود منطقهای پس از لنفادنکتومی بودند، بررسی کرد. این بیماران به دو گروه تحت نظر یا 48 گری پرتودرمانی طبقهبندی شدند. گروه تحت نظر، میزان عود 26.8٪ در مقابل 20٪ برای گروه پرتودرمانی کمکی داشت. با این حال، بقای کلی تفاوتی نداشت. با این حال، اهمیت کنترل موضعی در کاهش عوارض نباید دست کم گرفته شود و اهداف تحقیقاتی آینده ممکن است شامل کارآزماییهای بالینی تصادفی برای تعریف بیشتر نقش پرتودرمانی کمکی به تنهایی یا در ترکیب با درمان سیستمیک باشد. به طور کلی، بیمارانی که چندین گره لنفاوی منطقهای درگیر یا درهمتنیده دارند یا متاستازهای لنفاوی منطقهای آنها به خارج کپسول گسترش یافته است، ممکن است برای پرتودرمانی کمکی در چارچوب مراقبت چندرشتهای از بیمار مبتلا به ملانوم متاستاتیک در نظر گرفته شوند. پرتودرمانی با پرتو خارجی میتواند کنترل موضعی طولانیمدت و تسکین مؤثر را در برخی از بیماران مبتلا به ملانوم پیشرفته فراهم کند.
متاستازهای استخوانی علامتدار ناشی از ملانوم نیز اغلب به پرتودرمانی با پرتو خارجی پاسخ میدهند. علاوه بر این، بیماریهای زیر جلدی و غدد لنفاوی عودکننده نیز گاهی اوقات میتوانند به این روش درمان شوند، اگرچه پیشرفتهای قابل توجه در چشمانداز درمان ملانوم متاستاتیک، استفاده کلی از این رویکردها را کاهش داده است.
پیگیری و نظارت
ملانوم سیر بالینی متغیرتر و غیرقابل پیشبینیتری نسبت به تقریباً هر سرطان انسانی دیگری دارد. در MD Anderson، برنامه ارزیابیهای پیگیری برای بیماران مبتلا به ملانوم با توجه به خطر عود متفاوت است. به طور کلی، بیماران مبتلا به ملانوم تهاجمی در مراحل اولیه (مثلاً ضخامت تومور کمتر یا مساوی ۱ میلیمتر، بدون زخم، غدد لنفاوی منفی) هر ۶ ماه به مدت ۲ سال و سپس سالانه ویزیت میشوند. بیماران مبتلا به ملانومهای ضخیمتر یا زخمدار و بیمارانی که غدد لنفاوی مثبت دارند، معمولاً بیشتر برای ویزیتهای پیگیری مراجعه میکنند – هر ۳ تا ۴ ماه تا ۳ سال، هر ۶ ماه در طول سالهای ۳ و ۴ و پس از آن سالانه. در هر ویزیت، بیمار تحت معاینه فیزیکی با تمرکز بر بررسی پوست و معاینه حوضه غدد لنفاوی قرار میگیرد. یافتههای غیرطبیعی ممکن است نیاز به بررسی بیشتر داشته باشد. ارزیابی رادیوگرافی گسترده بیماران بدون علامت مبتلا به ملانوم AJCC مرحله I یا مرحله II که از نظر بالینی عاری از بیماری هستند، به ندرت متاستاز را نشان میدهد و بنابراین به طور معمول انجام نمیشود. ارزیابی رادیوگرافی معمولاً برای بیماران مبتلا به بیماری میکروسکوپی مرحله III قبل از درمان کمکی و به طور انتخابی قبل از تکمیل لنفادنکتومی برای SLN مثبت انجام میشود. سیتیاسکن یا PET/CT باید هر ۳ تا ۱۲ ماه (یا طبق کارآزمایی بالینی، در صورت شرکت در کارآزمایی) برای ارزیابی عود بیماری یا متاستاز جدید در بیماران مبتلا به بیماری مرحله III یا IV در نظر گرفته شود. MRI مغز نیز اغلب برای نظارت در بیمارانی که در مرحله IIIC یا IV هستند انجام میشود. نقش سونوگرافی برای نظارت بر حوضههای غدد لنفاوی منطقهای به خوبی تعریف نشده است، اگرچه باید برای بیمارانی که SLN مثبت دارند و تحت CLND قرار نمیگیرند، به شدت در نظر گرفته شود.

بدون دیدگاه