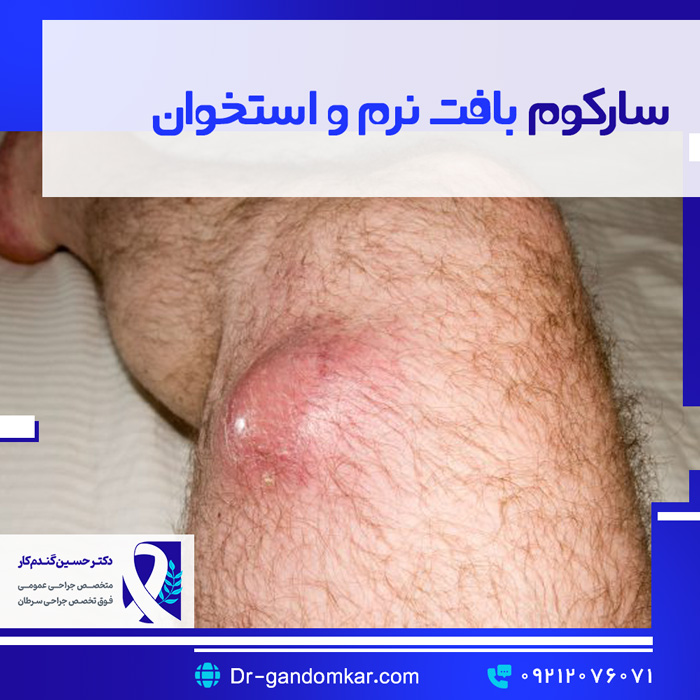
سارکومهای بافت نرم
سارکومها تومورهای نادری هستند؛ در سال ۲۰۱۶، بر اساس دادههای پایگاه داده نظارت، اپیدمیولوژی و نتایج نهایی (SEER)، تعداد تخمینی موارد جدید در ایالات متحده ۱۲۳۱۰ مورد (۰.۷٪ از کل موارد جدید سرطان) و تعداد تخمینی مرگ و میر ۴۹۹۰ مورد (۰.۸٪ از کل مرگ و میر ناشی از سرطان) بوده است. در زمان مراجعه، ۶۰٪ تا ۸۰٪ از بیماران بیماری موضعی یا منطقهای (متاستاز غدد لنفاوی) دارند، در حالی که ۱۵٪ تا ۲۰٪ بیماری متاستاتیک دارند. میزان بقای کلی ۵ ساله برای بیماران مبتلا به تمام مراحل سارکوم بافت نرم ۵۰٪ تا ۶۰٪ است، اما به طور قابل توجهی بر اساس مرحله متفاوت است (تقریباً ۸۰٪ در بیماران مبتلا به بیماری موضعی و ۲۰٪ در بیماران مبتلا به بیماری متاستاتیک). از بین بیمارانی که بر اثر سارکوم جان خود را از دست میدهند، اکثر آنها تسلیم بیماری متاستاتیک میشوند که در ۸۰٪ موارد طی ۲ تا ۳ سال پس از تشخیص اولیه رخ میدهد.
سارکومهای بافت نرم عمدتاً از مزودرم جنینی ناشی میشوند، اما میتوانند از اکتودرم نیز منشأ بگیرند. سلولهای مزودرمی باعث ایجاد بافتهای همبند توزیع شده در سراسر بدن میشوند. بنابراین، سارکومهای بافت نرم میتوانند در هر جایی از بدن رخ دهند. اکثر ضایعات اولیه از یک اندام (۴۵٪) منشأ میگیرند و محل آناتومیک بعدی که بیشترین شیوع را دارد، داخل شکمی/خلف صفاق (۴۰٪) و پس از آن تنه (۱۰٪) و ناحیه سر/گردن (۵٪) است (شکل ۵.۱). سارکوم یک گروه بیماری ناهمگن است که شامل بیش از ۶۰ زیرگروه بافتشناسی میشود. هر زیرگروه رفتار منحصر به فرد، الگوی عود متفاوت و بقای متمایز خود را دارد. به استثنای تومورهای استرومایی دستگاه گوارش (GISTs)، شایعترین انواع بافتشناسی سارکوم بافت نرم در بزرگسالان عبارتند از سارکوم تمایز نیافته/طبقهبندی نشده (با انواع پلئومورفیک، سلول گرد و سلول دوکی)، لیومیوسارکوم، لیپوسارکوم، سارکوم سینوویال و تومور بدخیم غلاف عصبی محیطی (MPNST) (شکل 5.2). رابدومیوسارکوم شایعترین سارکوم بافت نرم در دوران کودکی است. در سه دهه گذشته، یک رویکرد درمانی چندوجهی برای بیماران مبتلا به سارکوم بافت نرم اعمال شده است که نتایج درمان و کیفیت زندگی را بهبود بخشیده است. با این حال، تعداد قابل توجهی از بیماران مبتلا به سارکوم بافت نرم عود کرده و میمیرند، که نیاز به گزینههای درمانی سیستمیک بهبود یافته را برجسته میکند.
علتشناسی
اکثریت قریب به اتفاق سارکومها پراکنده و با علتشناسی ناشناخته هستند، اما تعدادی از عوامل با افزایش خطر ابتلا به سارکوم بافت نرم مرتبط بودهاند، از جمله قرار گرفتن در معرض تابش قبلی، لنفادم مزمن، استعداد ژنتیکی، تروما و مواد شیمیایی شغلی مانند اسیدهای فنوکسیاستیک و مواد نگهدارنده چوب حاوی کلروفنولها.
قرار گرفتن در معرض تابش قبلی
پرتودرمانی با پرتوهای خارجی یک علت نادر اما کاملاً اثبات شده برای سارکوم بافت نرم است. افزایش ۸ تا ۵۰ برابری در بروز سارکوم برای بیمارانی که تحت درمان با پرتودرمانی برای سرطانهای سینه، دهانه رحم، تخمدان، بیضه و سیستم لنفاوی قرار میگیرند، مشاهده شده است. علاوه بر این، خطر ابتلا به سارکوم پس از پرتودرمانی با دوز بالاتر افزایش مییابد. میانگین زمان تأخیر بین تابش و ایجاد سارکوم تقریباً ۱۰ سال است، اما میتواند از ۱ تا ۴۰ سال متغیر باشد. شایعترین انواع بافتشناسی سارکومهای مرتبط با پرتودرمانی عبارتند از سارکوم استئوژنیک، سارکوم تمایز نیافته/طبقهبندی نشده، آنژیوسارکوم و لنفانژیوسارکوم. سارکومهای مرتبط با پرتودرمانی در مقایسه با سارکومهای غیرمرتبط با پرتودرمانی، حتی زمانی که از نظر مرحله بیماری همسان باشند، با پیشآگهی بدتری همراه هستند.
 |
| شکل ۵.۱ توزیع بر اساس مکان برای بیماران بزرگسال مبتلا به سارکوم بافت نرم. (دادهها از DeVita VT Jr.، Lawrence TS، Rosenberg SA، ویراستاران. DeVita، Hellman، و Rosenberg’s Cancer: Principles and Practice of Oncology. ویرایش دهم. فیلادلفیا، پنسیلوانیا: Lippincott Williams & Wilkins؛ ۲۰۱۵: ۱۲۵۳–۱۲۹۱.) |
لنفادم مزمن
در سال ۱۹۴۸، استوارت و تروز اولین کسانی بودند که ارتباط بین لنفادم مزمن پس از تشریح زیر بغل و لنفانژیوسارکوم متعاقب آن را توصیف کردند. لنفانژیوسارکوم همچنین در بیماران پس از عفونتهای فیلاریایی و در اندامهای تحتانی بیماران مبتلا به لنفادم اولیه مادرزادی مشاهده شده است.
 |
| شکل 5.2 بافتشناسیهای رایج سارکوم بافت نرم. (دادهها از Coindre JM, Terrier P, Guillou L, و همکاران. ارزش پیشبینیکننده درجه برای توسعه متاستاز در انواع اصلی بافتشناسی سارکومهای بافت نرم بزرگسالان، مطالعهای بر روی 1240 بیمار از فدراسیون مراکز سرطان فرانسه، گروه سارکوم. سرطان2001;91:1914–1926.) |
استعداد ژنتیکی
چندین سندرم استعداد ژنتیکی که به خوبی توصیف شدهاند، با افزایش خطر ابتلا به زیرگروههای خاصی از سارکومهای استخوان و بافت نرم مرتبط هستند. به عنوان مثال، بیماران مبتلا به سندرم گاردنر (پولیپوز آدنوماتوز خانوادگی) میزان بروز تومورهای دسموئیدی بالاتری نسبت به حالت عادی دارند؛ بیماران مبتلا به جهشهای رده زایا در ژن سرکوبگر تومور p53 (سندرم لی-فرومنی) میزان بروز سارکوم بالایی دارند؛ و بیماران مبتلا به بیماری فون رکلینگهاوزن که ناهنجاریهایی در ژن نوروفیبروماتوز نوع 1 دارند، خطر ابتلا به MPNST در آنها افزایش مییابد. سارکومهای بافت نرم همچنین میتوانند در بیمارانی که رتینوبلاستومای ارثی به عنوان دومین بدخیمی اولیه دارند، رخ دهند.
چندین انکوژن با ایجاد سارکومهای بافت نرم مرتبط هستند، از جمله MDM2، CDK4، N-myc، c-erbB2 و اعضای خانواده ras. نشان داده شده است که تکثیر این انکوژنها با پیامد نامطلوب مرتبط است. تکثیر MDM2 و CDK4 اغلب در لیپوسارکومهای تمایز یافته یا تمایززدایی شده شناسایی میشوند و ممکن است در تأیید تشخیصهای بافتشناسی و همچنین به عنوان اهداف درمانی بالقوه مفید باشند.
تعدادی از جابجاییهای کروموزومی با زیرگروههای بافتشناسی خاص مرتبط بودهاند. چندین نوع جابجایی بین کروموزومهای 11 و 22 در سارکوم یوئینگ گزارش شده است. به طور مشابه، ادغام دو ژن جدید (SYT در 18q11 و SSX در Xp11) به عنوان یک جابجایی علت در اکثر (شاید همه) سارکومهای سینوویال شناسایی شده است. سایر جابجاییها یا بازآراییهای ژنی در لیپوسارکوم میکسوئید (FUS-DDIT3)، رابدومیوسارکوم آلوئولار (PAX3-FOXO1) و تومورهای سلول گرد کوچک دسموپلاستیک (EWS-WT1) به بهترین شکل مشخص میشوند. ژنهای سرکوبگر تومور، مانند رتینوبلاستوما (Rb) و ژن p53، نیز نقش مهمی در بسیاری از موارد سارکومهای بافت نرم دارند.
هیستوپاتولوژی
علیرغم وجود زیرگروههای متعدد و ناهمگن، سارکومها ویژگیهای بالینی و پاتولوژیک بسیاری را به اشتراک میگذارند. بنابراین، به طور سنتی، رژیمهای درمانی در طیف وسیعی از زیرگروههای مختلف مشابه بودهاند. درجه بافتشناسی همچنان مهمترین عامل پیشآگهی برای تعیین نتیجه است. با این حال، دادههای نوظهور نشان میدهند که طبقهبندی پاتولوژیک ممکن است در صورت در نظر گرفتن سایر متغیرهای پیش از درمان، نتایج را بهتر تعیین کند. رفتار تومور در بین زیرگروههای بافتشناسی به طور قابل توجهی متفاوت است. برای مثال، متاستاز غدد لنفاوی در سارکومهای بافت نرم نادر است (کمتر از ۵٪)، به جز در چند زیرگروه بافتشناسی، مانند سارکوم اپیتلیوئید، رابدومیوسارکوم، سارکوم سلول شفاف، آنژیوسارکوم و سارکوم پلئومورفیک تمایز نیافته (UPS). پتانسیل متاستاز نیز در بین زیرگروههای بافتشناسی به طور قابل توجهی متفاوت است. جدول ۵.۱ تفکیک انواع بافتشناسی تومورها را بر اساس پتانسیل متاستاز آنها نشان میدهد.
بهروزرسانیهای مهمی در سال ۲۰۱۳ در ویرایش چهارم طبقهبندی تومورهای بافت نرم و استخوان سازمان بهداشت جهانی انجام شد (لازم به ذکر است که یک فاصله ۱۱ ساله از ویرایش سوم وجود داشت). این ویرایش بهروز شده تغییرات زیادی را در طبقهبندی تومورها اعمال کرد و بینش ژنتیکی جدیدی در مورد پاتوژنز بسیاری از انواع مختلف تومور ارائه داد. در بهروزرسانی، دسته جدیدی از سارکومهای تمایز نیافته/طبقهبندی نشده ایجاد شد که شامل انواع پلئومورفیک، سلول دوکی، اپیتلیوئید و سلول گرد تمایز نیافته است و تقریباً 20٪ از کل سارکومها را تشکیل میدهد. توموری که قبلاً به عنوان هیستوسیتوم فیبری بدخیم (MFH) شناخته میشد، در این دسته قرار میگیرد. میکسوئید MFH به عنوان میکسوفیبروسارکوما طبقهبندی مجدد شد. دسته لیپوسارکوم نوع مختلط حذف شد زیرا این تومورها احتمالاً لیپوسارکوم تمایززدایی شده هستند. دسته لیپوسارکوم سلول گرد در زیرمجموعه لیپوسارکوم میکسوئید درجه بالا حذف شد زیرا لیپوسارکوم میکسوئید درجه بالا صرف نظر از مورفولوژی سلول گرد یا سلول دوکی، پیشآگهی یکسانی دارد. تکثیر MDM2 یا CDK4 اغلب در لیپوسارکومهای تمایز یافته و تمایززدایی شده یافت میشود. با این حال، نقش آنها در تمایز بین این زیرگروههای لیپوسارکوم به وضوح مشخص نشده است. GIST که قبلاً بخشی از طبقهبندی سیستم گوارش بود، برای اولین بار در طبقهبندی بافت نرم گنجانده شد. شایان ذکر است که از نظر تاریخی، اصطلاح لیپوسارکوم آتیپیک عموماً برای توصیف تومورهای آدیپوسیتیک درجه پایین واقع در اندام استفاده میشد، در حالی که لیپوسارکوم با تمایز خوب عموماً برای توصیف تومورهای آدیپوسیتیک از نظر پاتولوژیک مشابه که در پشت صفاق قرار داشتند، استفاده میشد، علیرغم اینکه این دو نوع تومور از نظر پاتولوژیک یکسان هستند. در حال حاضر، این اصطلاحات قابل تعویض هستند.
|
جدول 5.1تفکیک نوع بافتشناسی سارکوم بر اساس پتانسیل متاستاز |
 |
در ۲۵ تا ۴۰ درصد موارد، پاتولوژیستهای متخصص سارکوم ممکن است در مورد تشخیصهای بافتشناسی خاص یا معیارهای تعریف درجه تومور اختلاف نظر داشته باشند. این میزان تطابق پایین ممکن است ناشی از این واقعیت باشد که تعداد کمی از پاتولوژیستها در طول دوران حرفهای خود فرصت مطالعه بسیاری از این تومورهای نادر را دارند. همچنین بر نیاز به نشانگرهای مولکولی و بیوشیمیایی عینیتر برای بهبود دقت ارزیابی بافتشناسی مرسوم و همچنین بررسی تخصصی برای تشخیصهای مشکوک به سارکوم تأکید میکند.
در مرکز سرطان MD Anderson (MDACC)، درجهبندی سارکوم بافت نرم در بسیاری از موارد تقریباً مترادف با تعریف درجه از زیرگروههای بافتشناسی استفاده میکند. موارد زیر طبق تعریف درجه بالا هستند: UPS (که قبلاً MFH نام داشت)، سارکوم سینوویال، لیپوسارکوم پلئومورفیک، لیپوسارکوم تمایز نیافته، MPNST، رابدومیوسارکوم، سارکوم اپیتلیوئید، سارکوم سلول شفاف، سارکوم آلوئولار قسمت نرم، سارکوم یوئینگ، تومور نورواکتودرمال اولیه، استئوسارکوم و کندروسارکوم مزانشیمی. سارکومهای بافت نرم درجه متوسط شامل میکسوفیبروسارکوم، لیپوسارکوم میکسوئید، کندروسارکوم میکسوئید خارج اسکلتی و تومور فیبری منفرد (همانژیوپریسیتوما) هستند. سارکومهای بافت نرم درجه پایین شامل لیپوسارکوم با تمایز خوب هستند.
درجهبندی لیومیوسارکوم، فیبروسارکوم و سایر سارکومهای طبقهبندی نشده به صورت جداگانه توسط پاتولوژیستهای سارکوم بر اساس مورفولوژی بافتشناسی تعیین میشود.
مرحلهبندی و نتایج
سیستم مرحلهبندی کمیته مشترک سرطان آمریکا (AJCC) شامل پذیرفتهشدهترین سیستم مرحلهبندی سارکوم بافت نرم در جهان است و هشتمین ویرایش آن از راهنمای مرحلهبندی سرطان اخیراً منتشر شده است. این سیستم شامل دستهبندیهای مرحلهبندی زیر برای سارکومهای بافت نرم است:
درجه هیستوپاتولوژیک (G)، اندازه تومور (T)، درگیری غدد لنفاوی (N) و متاستازهای دوردست (M). تغییر قابل توجهی نسبت به ویرایش هفتم وجود دارد و آن ایجاد یک سیستم عملکردی است که میتواند به طور دقیق موارد بافتشناسی متنوعی را که مجموعه بیماریهایی را که تحت عنوان سارکوم بافت نرم قرار میگیرند، تشکیل میدهند، مرحلهبندی کند. یکی از قابل توجهترین تغییرات این است که سارکومهای بافت نرم بر اساس محل آناتومیک به سیستمهای مرحلهبندی مختلف تقسیم میشوند، به شرح زیر: سر و گردن، اندامها و تنه، شکم/اندامهای احشایی قفسه سینه، رتروپریتونئوم و سایر بافتشناسیها/محلها. در ویرایش هشتم، معیارهای دستهبندی T عمدتاً بر اساس محل آناتومیک متفاوت است و تمایز سطحی در مقابل عمقی حذف شده است.
گروهبندی مرحله پیشآگهی نیز برای هر دسته از محل آناتومیک منحصر به فرد است. با این حال، دسته سر/گردن و دسته اندامهای احشایی شکم/قفسه سینه، گروهبندی مرحلهای ندارند زیرا دادههای کافی به دلیل جدید بودن این دستهها در دسترس نیست. درگیری غدد لنفاوی (بیماری N1) که نادر است اما با بقای کم در سارکوم بافت نرم همراه است، در دسته خلف صفاقی به عنوان مرحله IIIB طبقهبندی میشود، در حالی که در دسته اندام/تنه به عنوان مرحله IV طبقهبندی میشود. درجه بافتشناسی (G1 تا G3) همچنان نقش مهمی در مرحلهبندی سارکوم بافت نرم ایفا میکند. ویرایش هشتم از سیستم درجهبندی سارکوم FNCLCC (فدراسیون ملی مراکز مبارزه با سرطان) بر اساس امتیاز تمایز تومور خاص بافتشناسی، تعداد میتوزی و نکروز تومور استفاده میکند. شایان ذکر است که تومورهای دسموئید/فیبروماتوز عمیق و سارکوم کاپوسی از سیستم مرحلهبندی سارکوم مستثنی ماندند. GIST همچنان یک سیستم مرحلهبندی منحصر به فرد دارد؛ اکنون در بخش سارکوم بافت نرم طبقهبندی میشود.
MDACC نتایج یک تجزیه و تحلیل گذشتهنگر از 1225 بیمار مبتلا به سارکوم بافت نرم موضعی که با جراحی و پرتودرمانی درمان شده بودند را گزارش کرد. با تجزیه و تحلیل چند متغیره، بافتشناسی درجه بالا یک عامل خطر برای عود موضعی و متاستازهای دوردست بود. میزان بقای 5 ساله مختص بیماری برای تومورهای درجه پایین، متوسط و بالا به ترتیب 96٪، 87٪ و 67٪ بود. زیرگروههای بافتشناسی رابدومیوسارکوم، سارکوم اپیتلیوئید و سارکوم سلول شفاف با بقای کوتاهتر مختص بیماری مرتبط بودند (خطر نسبی 1.6؛ فاصله اطمینان 95% [CI] 1.1 تا 2.2؛ p < 0.001). سایر عوامل خطر برای بقای مختص بیماری شامل اندازه بزرگ تومور (>5 سانتیمتر)، تومورهای واقع در سر/گردن یا تنه عمیق، سن>64 سال و وضعیت حاشیه مثبت یا نامشخص بود. شایان ذکر است که میزان عود غدد لنفاوی در این مطالعه در بین همه بیماران کم بود (<3%)، به جز بیمارانی که زیرگروههای بافتشناسی رابدومیوسارکوم (17% در 5 سال)، سارکوم اپیتلیوئید (18% در 5 سال) و سارکوم سلول شفاف (15% در 5 سال) داشتند. نوموگرامهای متعددی برای بهبود طبقهبندی خطر سارکوم خلف صفاقی (RPS) ایجاد شدهاند. MDACC یک نوموگرام پس از عمل برای بقای بیماران مبتلا به RPS منتشر کرد که بر اساس یک تحلیل گذشتهنگر از ۳۴۳ بیمار مبتلا به RPS بود که بین سالهای ۱۹۹۶ تا ۲۰۰۶ تحت عمل جراحی درمانی قرار گرفته بودند.
این نوموگرام شامل عوامل زیر است: سن (≥65 سال)، اندازه تومور (≥15 سانتیمتر)، نوع تظاهر (اولیه در مقابل عودکننده)، چندکانونی بودن، کامل بودن برداشت تومور و بافتشناسی. اخیراً، گرونچی و همکارانش یک نوموگرام بقا بر اساس مجموعه دادههای سه مرکز سرطان از RPS پس از برداشت اولیه منتشر کردند. تجزیه و تحلیل 523 بیمار جراحی شده با RPS اولیه، سن، اندازه تومور، درجه، زیرگروه بافتشناسی، چندکانونی بودن و وسعت برداشت تومور را به عنوان عوامل پیشآگهی برای بقای کلی (OS) نشان داد. نوموگرام آنها در 135 بیمار از یک موسسه چهارم اعتبارسنجی شد.
تظاهرات و تشخیص
تظاهرات بالینی سارکوم بافت نرم به محل آناتومیک و عمق تومور بستگی دارد. اکثر سارکومهای بافت نرم اندام به صورت یک توده بدون علامت تظاهر میکنند. اگرچه یک تومور سطحی (مثلاً تومورهای کمر یا دست) وقتی هنوز کوچک است، آشکار میشود، اما یک تومور عمیق (مثلاً تومورهای ران) میتواند قبل از آشکار شدن، به قطر 10 تا 15 سانتیمتر رشد کند. تومورهای خوشخیم (RPS) معمولاً به صورت یک توده بزرگ ظاهر میشوند (تقریباً 50٪ آنها هنگام تشخیص بزرگتر از 20 سانتیمتر هستند) زیرا اغلب تا زمانی که به اندازه کافی بزرگ نشوند که ساختارهای مجاور را فشرده یا به آنها حمله کنند، علائمی ایجاد نمیکنند. گاهی اوقات، بیماران ممکن است علائم عصبی ناشی از فشرده شدن اعصاب کمری یا لگنی یا علائم انسدادی دستگاه گوارش را نشان دهند.
ارزیابی رادیوگرافی
اهداف تصویربرداری رادیولوژیک قبل از درمان، تعیین دقیق وسعت موضعی تومور و رد بیماری متاستاتیک است. تصویربرداری رزونانس مغناطیسی (MRI) به عنوان تکنیک تصویربرداری انتخابی برای سارکومهای بافت نرم اندامها، جایگزین توموگرافی کامپیوتری (CT) شده است، مگر در بیمارانی که MRI در آنها منع مصرف دارد. MRI به طور دقیق گروههای عضلانی را مشخص میکند و بین استخوان، ساختارهای عروقی، ساختارهای عصبی و تومور تمایز قائل میشود. علاوه بر این، نماهای ساژیتال و کرونال امکان ارزیابی سهبعدی از بخشهای آناتومیک را فراهم میکنند. در لیپوسارکومهای میکسوئید اندامها، باید سیتیاسکن شکم و لگن نیز انجام شود، زیرا این بیماری به بافت چربی شکم و خلف صفاق و همچنین اسکلت محوری متاستاز میدهد.
در اکثر قریب به اتفاق سارکومها، محل غالب متاستاز ریه است و سیتیاسکن قفسه سینه اغلب در بیماران با ضایعات درجه بالا برای رد بیماری متاستاتیک استفاده میشود. ارزیابی رادیولوژیک خاص از سایر نواحی میتواند در بافتشناسیهای خاصی که الگوهای منحصر به فردی از گسترش متاستاز نشان دادهاند، نشان داده شود. نمونههایی از این موارد شامل تصویربرداری شکمی/خلف صفاق و استخوان در بیماران مبتلا به لیپوسارکوم میکسوئید اندامهای پیشرفته موضعی و تصویربرداری مغز در بیماران مبتلا به سارکوم آلوئولار قسمت نرم است. در سایر بافتشناسیهای سارکوم، جستجو برای متاستازهای استخوان و مغز به ندرت نشان داده میشود، مگر اینکه بیمار علائم مرتبط داشته باشد. یک مطالعه گذشتهنگر روی ۱۱۷۰ بیمار مبتلا به سارکوم بافت نرم اندام نشان داد که ۱۰٪ از آنها در زمان مراجعه متاستاز دوردست داشتند و ۸۳٪ از این متاستازها در ریه قرار داشتند.
در میان بیمارانی که متاستاز ریه داشتند، ۶۳٪ از متاستازها با عکسبرداری معمول قفسه سینه (CXR) تشخیص داده شدند، در حالی که در ۳۷٪، CXRها طبیعی به نظر میرسیدند. خطر بالاتر متاستاز در زمان مراجعه در ضایعات عمیق (۹٪ در مقابل ۴٪) و در تومورهای درجه بالا (۱۱.۸٪ در مقابل ۷.۰٪ در تومورهای درجه متوسط و ۱.۲٪ در تومورهای درجه پایین) مشاهده شد. در مورد زیرگروههای بافتشناسی، خطر بالاتر متاستاز ریه در سارکوم یوئینگ (۲۵٪)، MPNST (۱۶٪)، کندروسارکوم خارج اسکلتی (۱۴٪) و سارکوم پلئومورفیک (۱۱٪) مشاهده شد. نویسندگان نتیجه گرفتند که همه بیماران مبتلا به سارکوم بافت نرم باید CXR داشته باشند و سیتیاسکن قفسه سینه برای بیمارانی که ضایعه مشکوک در CXR دارند یا برای بیمارانی که تومور پرخطر دارند (اندازه تومور بزرگ [>5 سانتیمتر]، محل تومور عمیق یا بافتشناسی متوسط/بالا) در نظر گرفته شده است.
سیتیاسکن همچنان تکنیک تصویربرداری انتخابی برای RPSها است. علاوه بر ارائه اطلاعات ارزشمند در مورد ملاحظات آناتومیک، ظرافتهای رادیولوژیکی بین انواع مختلف بافتشناسی را میتوان با سیتیاسکن درک کرد.
نقش اسکن توموگرافی انتشار پوزیترون (PET) در بیماران مبتلا به سارکوم به خوبی تعریف نشده است. بسیاری از انواع تومورهای خوشخیم عضلانی-اسکلتی (به عنوان مثال، شوانوما) میتوانند جذب فلورودئوکسی گلوکز F-18 (FDG) را در درجات مختلف نشان دهند، که تعیین نقش PET در مرحلهبندی بیماران مبتلا به سارکوم را دشوار میکند.
بیوپسی و ارزیابی پاتولوژیک
تشخیص دقیق بافتشناسی قبل از عمل در تعیین درمان اولیه سارکوم بافت نرم بسیار مهم است. بیوپسی باید بافت کافی را به دست دهد تا بتوان بدون افزایش خطر عوارض، تشخیص پاتولوژیک انجام داد. بیوپسی سوزنی با یا بدون آسپیراسیون با سوزن ظریف، به عنوان وسیلهای قابل اعتماد برای به دست آوردن مواد کافی برای تشخیص پاتولوژیک دقیق، به ویژه هنگامی که یافتههای پاتولوژیک با یافتههای بالینی و تصویربرداری ارتباط نزدیکی دارند، نشان داده شده است. بیوپسی انجام شده تحت هدایت سونوگرافی یا سیتیاسکن میتواند دقت تشخیصی را بهبود بخشد.
با این حال، به دلیل هترکوما میتواند منجر به تشخیص اشتباه شود. MDACC یک مطالعه گذشتهنگر از ۱۲۰ بیمار مبتلا به لیپوسارکومهای خلف صفاقی گزارش کرد که نشان داد دقت تشخیصی کلی زیرگروه خاص بیوپسی از راه پوست ۶۳٪ بود. این دقت به ویژه در بیماران مبتلا به لیپوسارکوم تمایز نیافته (۳۶٪) کمتر بود، که احتمالاً ثانویه به خطای نمونهبرداری و تنوع مورفولوژیکی لیپوسارکوم تمایز نیافته است. گنجاندن اطلاعات رادیوگرافی در ارزیابی بافتشناسی برای بهبود دقت تشخیصی در بیماران مبتلا به اندامهای عمقی یا RPSها مهم است. یکی از کاربردهای بالقوه اسکن PET برای هدایت بیوپسی است. بسیاری از RPSها ناهمگن هستند و اسکن PET ممکن است به شناسایی وجود یک جزء بسیار فعال در تومور ناهمگن کمک کند. هنگامی که بیوپسی از راه پوست و با هدایت تصویر انجام میشود، میتوان ناحیهای را که در اسکن PET به عنوان فعال شناسایی شده است، هدف قرار داد.
رویکرد درمانی
درمان سارکومها نیاز به یک رویکرد چند رشتهای دارد. در MDACC، موارد سارکوم به طور منظم در کنفرانسهای چند رشتهای که شامل رادیولوژیستها، پاتولوژیستها، انکولوژیستهای جراحی، انکولوژیستهای پزشکی و انکولوژیستهای پرتودرمانی میشود، مورد بحث قرار میگیرد. شیمیدرمانی و/یا پرتودرمانی قبل از عمل اغلب در بیماران منتخب استفاده میشود. استراتژیهای درمانی باید در موارد فردی مورد بحث قرار گیرند و باید بر اساس تعدادی از عوامل، به ویژه محل تومور، اندازه و درجه/زیرگروههای بافتشناسی باشند. اصول کلی درمان شامل حداکثر کنترل موضعی-منطقهای با برداشتن کامل جراحی در صورت امکان، پرتودرمانی قبل یا بعد از عمل و/یا شیمیدرمانی است.
پیگیری
منطق پشت استراتژیهای پیگیری فعال برای تشخیص عود در بیماران مبتلا به سارکومهای بافت نرم این است که تشخیص و درمان زودهنگام بیماری عودکننده میتواند بقای بیماران را طولانیتر کند. سارکومهای اندامها اغلب به صورت متاستازهای ریوی عود میکنند، در حالی که سارکومهای خلف صفاقی یا داخل شکمی معمولاً به صورت موضعی عود میکنند. الگوهای عود نیز بسته به زیرگروههای بافتشناسی متفاوت است. اکثر سارکومهای بافت نرم که عود میکنند، در عرض ۲ سال اول پس از اتمام درمان عود میکنند. بنابراین، بیماران باید هر ۳ ماه یکبار با تصویربرداری قفسه سینه (همانطور که قبلاً ذکر شد) و تصویربرداری از محل اولیه در طول این دوره پرخطر معاینه شوند. اکثر متخصصان توصیه میکنند که محل اولیه با MRI برای تومور اندام یا CT برای تومورهای داخل شکمی یا خلف صفاق ارزیابی شود. در برخی شرایط، میتوان از سونوگرافی برای بررسی عود موضعی تومور اندام استفاده کرد. فواصل پیگیری ممکن است در طول سالهای ۲ تا ۵ پس از اتمام درمان به هر ۶ ماه افزایش یابد. پس از ۵ سال، بیماران باید سالانه با تصویربرداری از قفسه سینه و محل اولیه و معاینه فیزیکی ارزیابی شوند.
سارکومهای بافت نرم اندام
بیش از ۵۰٪ سارکومهای بافت نرم از اندام منشأ میگیرند. شایعترین زیرگروههای بافتشناسی شامل سارکومهای تمایز نیافته/طبقهبندی نشده (که قبلاً MFH نامیده میشد)، لیپوسارکوم، سارکوم سینوویال و فیبروسارکوم هستند، اگرچه انواع مختلف بافتشناسی دیگری نیز در اندامها مشاهده میشوند.
جراحی
درمان اصلی، برداشتن جراحی حاشیه منفی است. میزان برداشتن جراحی بر اساس محل تومور، اندازه تومور، عمق تهاجم، درگیری ساختارهای مجاور و وضعیت عملکرد بیمار تعیین میشود. در دهه 1970، 50٪ از بیماران مبتلا به سارکوم اندام با قطع عضو درمان شدند. با این حال، با وجود میزان عود موضعی کمتر از 10٪ پس از قطع عضو، تعداد زیادی از بیماران همچنان بر اثر بیماری متاستاتیک جان خود را از دست دادند. این درک منجر به توسعه یک الگوریتم درمانی اجماعی شامل برداشتن جراحی اندام با حفظ اندام همراه با پرتودرمانی پس از عمل شد. یک کارآزمایی تصادفی برجسته از موسسه ملی سرطان توسط روزنبرگ و همکاران. در سال ۱۹۸۲، هیچ تفاوتی در میزان بقا در بین بیمارانی که با جراحی حفظ عضو به همراه پرتودرمانی درمان شدند، در مقایسه با بیمارانی که با قطع عضو درمان شدند، نشان داده نشد. در سال ۱۹۸۵، بر اساس دادههای محدود موجود، مؤسسات ملی بهداشت بیانیهای اجماعی صادر کردند که جراحی حفظ عضو را برای اکثر بیماران مبتلا به سارکومهای اندام درجه بالا توصیه میکرد.
با این حال، قطع عضو همچنان درمان انتخابی برای بیمارانی است که تومور آنها را نمیتوان با روش حفظ عضو که عملکرد را حفظ میکند، به طور کلی برداشت کرد (کمتر از ۵٪ موارد).
برداشتن رادیکال و گسترده، درمان اصلی سارکومهای اندام است که در حالت ایدهآل، در صورت امکان، حاشیه ۲ سانتیمتری دارد. با این حال، هنگامی که این امر قابل دستیابی نیست (یعنی در اطراف ساختارهای عصبی عروقی)، جراحان باید تلاش کنند تا اعصاب اصلی را حفظ کنند، زیرا تهاجم واقعی به این ساختارها نادر است. مهم است به یاد داشته باشید که معمولاً ناحیهای از بافت واکنشی فشرده وجود دارد که یک کپسول کاذب در اطراف تومورها تشکیل میدهد و تومورها ممکن است فراتر از این کپسول کاذب گسترش یابند. در صورت امکان، محل یا مسیر بیوپسی نیز باید به صورت یکپارچه با نمونه برداشته شده همراه باشد.
قبل از مراجعه به مرکز بیمارمحور، انجام رزکسیون غیربهینه توسط جراحان بیتجربه به دلیل برنامهریزی ناکافی جراحی، غیرمعمول نیست. برای این بیماران، رزکسیون مجدد در صورت عدم اختلال عملکردی، همراه با پرتودرمانی قبل یا بعد از عمل ترجیح داده میشود. در مواردی که هیچ تومور رادیولوژیکی یا بالینی آشکاری وجود ندارد، که در آن رزکسیون مجدد احتمالاً باعث اختلال عملکردی میشود، پرتودرمانی یک گزینه جایگزین است. در MDACC، از بین 666 بیماری که قبل از مراجعه به MDACC بدون بیماری ماکروسکوپی آشکار، تحت رزکسیون کامل تومور قرار گرفتند، 295 بیمار (44٪) تحت رزکسیون مجدد قرار گرفتند.
در بین کسانی که تحت رزکسیون مجدد قرار گرفتند، 136 بیمار (46٪) تومور باقیمانده داشتند. میزان کنترل موضعی 5 ساله در گروه رزکسیون مجدد 85٪ و در گروه بدون رزکسیون مجدد 78٪ بود (0.03 = p)، حتی اگر گروه رزکسیون مجدد نسبت بالاتری از حاشیههای مثبت در رزکسیون قبل از ارجاع داشتند. برداشتن مجدد تومور، پس از تجزیه و تحلیل چند متغیره، همچنان پیشبینیکنندهی مهمی برای بهبود بقا بود.
لنفادنکتومی منطقهای انتخابی به ندرت در بیماران مبتلا به سارکومهای بافت نرم اندیکاسیون دارد. با این حال، در بیمارانی که بافتشناسی آنها خطر بالای متاستاز غدد لنفاوی را نشان میدهد (مانند رابدومیوسارکوم، سارکوم اپیتلیوئید، سارکوم سلول شفاف و UPS)، آسپیراسیون با سوزن ظریف یا بیوپسی با سوزن مرکزی باید از غدد لنفاوی مشکوک از نظر رادیوگرافی انجام شود. در چنین مواردی، لنفادنکتومی فقط در صورتی توصیه میشود که یافتهها مثبت باشند. نقش بیوپسی غدد لنفاوی نگهبان در زیرگروههای بافتشناسی مستعد متاستاز غدد لنفاوی همچنان بحثبرانگیز است.
MDACC یک مطالعه گذشتهنگر از 35 بیمار مبتلا به متاستاز غدد لنفاوی همزمان (43٪، n = 15) یا متاکرون (57٪، n = 20) جدا شده از سارکومهای بافت نرم اندام که تحت لنفادنکتومی قرار گرفتند، گزارش کرد. سارکوم اپیتلیوئید (23%) و MFH (23%) شایعترین زیرگروههای بافتشناسی بودند که در این مطالعه متاستاز غدد لنفاوی داشتند و پس از آن سارکوم سلول شفاف (17%) قرار داشت. میزان بقای کلی (OS) تخمینی 1، 2 و 5 ساله در بیمارانی که متاستاز غدد لنفاوی آنها ثبت شده و تحت لنفادنکتومی قرار گرفتند، به ترتیب 91%، 82% و 60% بود. این نتایج به نتایج تاریخی بیماران مبتلا به بیماری مرحله III (OS 5 ساله 50%) در مقایسه با OS 5 ساله بیماران مبتلا به بیماری مرحله IV (25%) نزدیکتر بود، بنابراین نشان میدهد که رویکردهای جراحی تهاجمی، مانند تشریح غدد لنفاوی منطقهای در بیماران مبتلا به متاستاز غدد لنفاوی تایید شده، میتواند تأثیر مثبتی بر بقا داشته باشد.
درمان چندوجهی
پرتودرمانی
هدف اصلی پرتودرمانی، بهینهسازی کنترل تومور موضعی است. شواهد مربوط به پرتودرمانی کمکی در بیمارانی که واجد شرایط برداشتن جراحی با حفظ اندام هستند، از دو کارآزمایی تصادفی و تعدادی از گزارشهای بزرگ تکموسسهای به دست میآید. در اواخر دهه ۱۹۹۰، دو کارآزمایی تصادفی کنترلشده شاخص منتشر شد که پرتودرمانی پس از عمل را برای بیماران مبتلا به سارکوم بافت نرم اندام که واجد شرایط برداشتن جراحی با حفظ اندام بودند، ترجیح میدادند. این مطالعه که در موسسه ملی سرطان انجام شد، ۹۱ بیمار مبتلا به تومورهای اندام با درجه بالا را به صورت تصادفی به دو گروه جراحی با حفظ اندام و به دنبال آن شیمیدرمانی به تنهایی یا پرتودرمانی به همراه شیمیدرمانی پس از عمل تقسیم کرد. گروه دوم متشکل از ۵۰ بیمار مبتلا به تومورهای درجه پایین، با برداشتن تنها اندام در مقابل برداشتن تومور با پرتودرمانی درمان شدند. میزان کلی کنترل موضعی ۱۰ ساله با پرتودرمانی ۹۸٪ در مقابل ۷۰٪ بدون پرتودرمانی بود و بهبود میزان کنترل موضعی با پرتودرمانی در هر دو گروه تومور با درجه بالا و پایین مشاهده شد. با این حال، تجزیه و تحلیل کیفیت زندگی نشان داد که پرتودرمانی منجر به کاهش قدرت اندام، ادم و دامنه حرکتی میشود، اگرچه این عوارض جانبی اغلب گذرا بودند و تأثیر کمی بر فعالیتهای روزانه داشتند. در یک کارآزمایی تصادفی دوم که در مرکز سرطان مموریال اسلون کترینگ (MSKCC) انجام شد، 164 بیمار پس از جراحی حفظ اندام برای اندام یا برداشتن سارکومهای بافت نرم سطحی تنه، به صورت تصادفی به دو گروه مشاهده یا براکیتراپی (42 تا 45 گری) تقسیم شدند. میزان کنترل موضعی 5 ساله در گروه براکیتراپی به ترتیب 82٪ در مقابل 69٪ در گروه نوبراکیتراپی بود (0.04 = p). در تجزیه و تحلیل زیرمجموعه گروه تومور درجه پایین (45 = n)، هیچ مزیتی برای براکیتراپی در کنترل موضعی وجود نداشت (0.49 = p). در هر دو مطالعه، هیچ مزیتی در بقا در گروه پرتودرمانی مشاهده نشد.
براکیتراپی
براکیتراپی، که شامل قرار دادن چندین کاتتر در بستر برداشتن تومور در زمان جراحی است، گزارش شده است که به میزان کنترل موضعی قابل مقایسه با میزان کنترل حاصل از پرتودرمانی خارجی دست مییابد. دستورالعملهایی وضع شده است که توصیه میکند کاتترهای پسبارگذاری را در فواصل ۱ سانتیمتری با حاشیه ۲ سانتیمتری در اطراف بستر جراحی قرار دهید. معمولاً، پس از پنجمین روز پس از عمل، کاتترها با سیمهای رادیواکتیو (ایریدیوم-۱۹۲) بارگذاری میشوند که ۴۲ تا ۴۵ گری را طی ۴ تا ۶ روز به بستر تومور میرسانند. فراوانی عوارض زخم مرتبط با براکیتراپی مشابه عوارض مشاهده شده در پرتودرمانی پس از عمل است (تقریباً 10٪).
مزیت اصلی براکیتراپی، زمان کلی کوتاهتر درمان 4 تا 6 روز است، در مقایسه با 4 تا 6 هفتهای که معمولاً برای رژیمهای پرتودرمانی با پرتو خارجی قبل یا بعد از عمل مورد نیاز است. براکیتراپی همچنین پراکندگی تابش کمتری در مناطق آناتومیک بحرانی (مانند غدد جنسی، مفاصل) ایجاد میکند، و بهبود عملکرد یک مزیت بالینی بالقوه است. مقایسههای تجزیه و تحلیل هزینه براکیتراپی در مقابل پرتودرمانی با پرتو خارجی، نشان داده است که هزینههای پرتودرمانی پس از عمل با براکیتراپی کمتر از پرتودرمانی با پرتو خارجی است.
بر اساس شواهد حاصل از این مطالعات، پرتودرمانی همراه با جراحی حاشیه منفی برای بیماران مبتلا به تومورهای درجه متوسط تا بالا برای بهبود کنترل موضعی توصیه میشود. از آنجا که تومورهای T1 (کمتر از 5 سانتیمتر) کمتر با عود موضعی همراه هستند، پرتودرمانی را میتوان در مواردی که خطر عود کم و حاشیههای وسیع (حداقل 1 سانتیمتر) دارند، حذف کرد. برای تومورهای درجه پایین، پرتودرمانی میتواند در مواردی با حاشیه مثبت یا نزدیک (<1 سانتیمتر) در نظر گرفته شود.
پرتودرمانی قبل از عمل در مقابل پرتودرمانی بعد از عمل
زمان بهینه پرتودرمانی برای سارکومهای بافت نرم همچنان مورد توجه تحقیقات فعال است. مزایای بالقوهای در هر دو رویکرد پرتودرمانی قبل از عمل و بعد از عمل وجود دارد. در پرتودرمانی قبل از عمل، خود تومور ساختارهای طبیعی را جابجا میکند و آنها را از قرار گرفتن در معرض تابش محافظت میکند، که به محدود کردن سمیت ساختارهای طبیعی اطراف کمک میکند. علاوه بر این، این پتانسیل وجود دارد که پرتودرمانی بار تومور را کاهش دهد و امکان برداشتن جراحی محدودتر و محافظهکارانهتر را فراهم کند. رویکرد بعد از عمل امکان بررسی بافتشناسی بهتر نمونههای برداشته شده را بدون تحریف اثر درمان فراهم میکند و با عوارض حاد زخم کمتری همراه است. در حال حاضر، تنها کارآزمایی تصادفی موجود که پرتودرمانی قبل از عمل و بعد از عمل را مقایسه میکند، یک کارآزمایی چند مرکزی است که در کانادا انجام شد و ۱۹۰ بیمار مبتلا به سارکوم بافت نرم اندام اولیه (۹۰٪) یا عودکننده (۱۰٪)، که عمدتاً درجه متوسط یا بالا (۸۳٪) داشتند را به صورت تصادفی برای دریافت ۵۰ گری پرتودرمانی قبل از عمل یا ۶۶ گری پرتودرمانی خارجی بعد از عمل، همراه با جراحی برداشتن اندام، انتخاب کرد. بیمارانی که حاشیههای مثبت در گروه قبل از عمل داشتند، ۱۶ تا ۲۰ گری دوز تقویتی بعد از عمل دریافت کردند. این مطالعه به دلیل میزان بالاتر عوارض حاد زخم در گروه درمان قبل از عمل (۳۵٪ در مقابل ۱۷٪، p = ۰.۰۱)، در تجزیه و تحلیل موقت متوقف شد. در بهروزرسانی این مطالعه با میانگین پیگیری ۶.۹ سال، هیچ تفاوت معنیداری بین دو گروه در میزان کنترل موضعی ۵ ساله (۹۳٪ در گروه درمان قبل از عمل در مقابل ۹۲٪ در گروه درمان بعد از عمل) و میزان بقای کلی ۵ ساله (۷۳٪ در گروه درمان قبل از عمل در مقابل ۶۷٪ در گروه درمان بعد از عمل؛ p = ۰.۴۸) گزارش نشد. در مورد سمیت دیررس، این مطالعه میزان بالاتری از فیبروز درجه ۲ یا بیشتر را در گروه درمان بعد از عمل نشان داد (۴۸٪ در مقابل ۳۲٪؛ p = ۰.۰۷) که با اختلال عملکرد همراه بود.
در MDACC، ما به چند دلیل رویکرد قبل از عمل را نسبت به رویکرد بعد از عمل برای اکثر بیماران مبتلا به سارکوم بافت نرم اندام ترجیح میدهیم. اول، پرتودرمانی بعد از عمل میزان بالاتری از سمیت دیررس دارد که معمولاً برگشتناپذیر است (در مقابل، عوارض حاد زخم معمولاً قابل کنترل هستند و در نهایت بهبود مییابند). دوم، میتوان از دوزهای پایینتر و اندازههای میدان کوچکتر در رویکرد قبل از عمل نسبت به رویکرد بعد از عمل استفاده کرد. سوم، فناوریهای پرتودرمانی که به سرعت در حال بهبود هستند، مانند پرتودرمانی با شدت تعدیلشده (IMRT)، در شرایط قبل از عمل مؤثرتر هستند، جایی که میتوان تومور را به طور دقیق هدف قرار داد و دوز تابشی که به ساختارهای اطراف میرسد را به حداقل رساند. این امر میتواند به ویژه در جلوگیری از آسیب تابشی به مفاصل مهم باشد. در نهایت، تکنیکهای جراحی پلاستیک که شامل روشهای پیشرفته انتقال بافت هستند، بیشتر در بیماران مبتلا به زخمهای پرخطر استفاده میشوند و این میتواند به میزان موفقیت بالایی (بیش از 90٪) در بهبود زخمها از یک عمل تک مرحلهای منجر شود. استراتژی درمان سارکومهای اندام تحت درمان در MDACC در شکل 5.3 خلاصه شده است.
شیمی درمانی
علیرغم بهبود در میزان کنترل موضعی، متاستاز و مرگ همچنان مشکلات قابل توجهی برای بیماران مبتلا به سارکومهای بافت نرم پرخطر هستند. این گروه پرخطر شامل سارکومهای موضعی در مکانهای غیر اندامی، تومورهایی که بافتشناسی متوسط یا بالا نشان میدهند یا تومورهای بزرگ (T2) است. رژیم درمانی برای بیماران مبتلا به بیماری موضعی پرخطر، بیماری متاستاتیک یا هر دو، معمولاً شامل شیمیدرمانی است.
شیمیدرمانی سیستمیک بخش مهمی از چندین سارکوم است که عمدتاً در کودکان رخ میدهد، مانند رابدومیوسارکوم، سارکوم یوئینگ و سارکوم استئوژنیک. همچنین به خوبی شناخته شده است که لیپوسارکوم میکسوئید و سارکوم سینوویال، سارکومهای بافت نرم حساس به شیمیدرمانی هستند.
تنها سه دارو، دوکسوروبیسین، داکاربازین و ایفوسفامید، به طور مداوم به میزان پاسخ حداقل 20٪ به عنوان درمانهای تک عاملی در بیماران مبتلا به سارکومهای بافت نرم پیشرفته دست یافتهاند. اکثر آزمایشهای شیمیدرمانی فعال، دوکسوروبیسین را به عنوان بخشی از رژیم درمانی گنجاندهاند. میزان پاسخ به ایفوسفامید در سریهای تک موسسهای که در آنها از رژیمهای دوز بالاتر استفاده شده یا ایفوسفامید در ترکیب با دوکسوروبیسین داده شده است، از 20٪ تا 60٪ متغیر است. اخیراً، چندین دارو برای بیماران مبتلا به سارکوم متاستاتیک توسط FDA تأیید شدهاند. ترابکتدین، یک عامل اتصالدهنده به DNA، برای بیماران مبتلا به لیپوسارکوم یا لیومیوسارکوم تأیید شده است. اریبولین یک عامل مهارکننده میکروتوبول است که در درمان لیپوسارکوم تأیید شده است. اولاراتوماب یک آنتیبادی مونوکلونال مسدودکننده گیرنده PDGFR-α است که اخیراً (11/2016) در ترکیب با دوکسوروبیسین در هر بافتشناسی سارکوم بافت نرم بالغ که به طور مناسب با رژیم حاوی آنتراسیکلین درمان میشود، تأیید شده است.
 |
| شکل ۵.۳ استراتژی درمانی برای سارکومهای بافت نرم اندام. |
*درجه پایین: XRT برای بیماران منتخب با سرطان اولیه عودکننده یا عمیقاً ارتشاحی در نظر گرفته شده است. سونوگرافی، سونوگرافی؛ LN، غدد لنفاوی؛ سیتیاسکن، توموگرافی کامپیوتری؛ MRI، تصویربرداری رزونانس مغناطیسی؛ UPS، سارکوم پلئومورفیک طبقهبندی نشده.
شیمیدرمانی پس از عمل
کارآزماییهای تصادفی فردی شیمیدرمانی پس از عمل نتوانستهاند بهبودی در بقای بدون بیماری یا بقای کلی در بیماران مبتلا به سارکوم بافت نرم را نشان دهند. با این حال، انتقادات متعددی به این کارآزماییهای فردی وجود دارد که ممکن است توضیح دهد که چرا آنها نتوانستهاند بهبود در بقا را نشان دهند. اول، رژیمهای شیمیدرمانی مورد استفاده بهینه نبودند، به این معنی که داروهای تکدارویی (اغلب دوکسوروبیسین) مورد مطالعه قرار گرفتند و برنامههای دوزبندی کمتر فشرده بودند. دوم، اندازه نمونه در این کارآزماییها به اندازه کافی بزرگ نبود که امکان تشخیص تفاوتهای بالینی معنیدار در بقا را فراهم کند. سوم، اکثر بیمارانی که به رژیم درمانی اولیه پاسخ ندادند، با رژیمهای شیمیدرمانی دیگری که به طور بالقوه بر بقای بدون بیماری و بقای کلی تأثیر میگذارند، شروع شدند. در نهایت، اکثر مطالعات شامل بیمارانی بودند که در معرض خطر کم متاستاز و مرگ بودند، یعنی افرادی که تومورهای کوچک (<5 سانتیمتر) و درجه پایین داشتند. از این رو، نقش شیمیدرمانی پس از عمل در سارکوم بافت نرم بحثبرانگیز بوده است. اولین کارآزمایی تصادفی شیمیدرمانی پس از عمل برای سارکومهای بافت نرم در سال ۱۹۷۳ در MDACC انجام شد و بهبود بقای بدون بیماری را در گروه شیمیدرمانی نشان داد.
از آن زمان، کارآزماییهای تصادفی متعددی با نتایج متناقض انجام شده است. یک متاآنالیز رسمی توسط همکاری متاآنالیز سارکوم در سال ۱۹۹۷ انجام شد؛ این گروه دادههای ۱۵۶۸ بیمار را در ۱۴ کارآزمایی شیمیدرمانی پس از عمل مبتنی بر دوکسوروبیسین تجزیه و تحلیل کردند تا تأثیر شیمیدرمانی پس از عمل بر سارکومهای بافت نرم موضعی و قابل برداشت را تعیین کنند. در این کارآزمایی، با میانگین پیگیری ۹.۴ سال، شیمیدرمانی مبتنی بر دوکسوروبیسین به طور قابل توجهی زمان عود موضعی و دوردست و بقای کلی بدون عود را افزایش داد. در گروه درمان پس از عمل، روندی به سمت بهبود بقای کلی (OS) وجود داشت (HR برای مرگ 0.89، 95% CI 0.76 تا 1.03؛ p = 0.12)، اما سود مطلق در 10 سال تنها 4٪ بود. همین گروه با اضافه کردن چندین کارآزمایی تصادفی بعدی، تجزیه و تحلیل را بهروزرسانی کرد. نتایج حاصل از تجزیه و تحلیل بهروز شده دادههای 18 کارآزمایی، که شامل 1953 بیمار بود، مشابه نتایج تجزیه و تحلیل قبلی بود. با این حال، نشان داد که استفاده از دوکسوروبیسین همراه با ایفوسفامید با بهبود بقای کلی (OR 0.56، 95% CI 0.36 تا 0.85؛ p = 0.01) همراه است، با کاهش خطر مطلق 11٪ (41٪ در مقابل 30٪) (جدول 5.2). بر اساس این تجزیه و تحلیلها، یک رژیم شیمیدرمانی شامل ایفوسفامید به طور کلی توصیه میشود.
| جدول5.2متاآنالیز شیمی درمانی کمکی برای سارکوم بافت نرم (همکاری متاآنالیز سارکوم، ۲۰۰۸) |
 |
با این حال، استفاده از شیمیدرمانی پس از عمل برای سارکومهای بافت نرم قابل برداشت همچنان بحثبرانگیز است. متاآنالیزهای ذکر شده در بالا شامل دو کارآزمایی تصادفی بزرگ اخیر انجام شده توسط سازمان اروپایی تحقیقات و درمان سرطان (EORTC) نبودند. این مطالعات رژیمهای حاوی دوکسوروبیسین/ایفوسفامید را آزمایش کردند. تجزیه و تحلیل تجمیعی از مجموع 819 بیمار از این دو مطالعه نشان داد که شیمیدرمانی پس از عمل با بهبود بقای بدون عود همراه است (HR 0.74، 95% CI 0.60 تا 0.92؛ p = 0.006)، اما با بقای کلی مرتبط نیست.
شیمیدرمانی قبل از عمل
مزایای بالقوه شیمیدرمانی قبل از عمل نسبت به رویکرد پس از عمل شامل کاهش تومور (که ممکن است امکان برداشت محدودتر را فراهم کند)، درمان زودهنگام میکرومتاستازهای بالقوه، انتخاب بیمار برای جراحی در مواردی با تومورهای قابل برداشت مرزی یا تومورهایی با متاستازهای مشکوک، و از همه مهمتر، ارزیابی درون تنی اثربخشی درمان است. با توجه به اینکه تنها 30 تا 50 درصد از بیماران به رژیمهای شیمیدرمانی استاندارد پاسخ میدهند، یک رویکرد قبل از عمل، متخصص انکولوژی را قادر میسازد تا بیمارانی را که به رژیمهای خاص پاسخ میدهند، همانطور که از نظر رادیوگرافی و پاتولوژی نشان داده شده است، شناسایی کند. پاسخدهندگان به درمان پس از دو یا چهار دوره شیمیدرمانی، متعاقباً تحت عمل جراحی قرار میگیرند، که اغلب پس از پرتودرمانی قبل از عمل انجام میشود، و سپس شیمیدرمانی بعد از عمل را با همان عواملی که برای آنها مؤثر شناخته شده است، ادامه میدهند. علاوه بر این، بیمارانی که به دورههای کوتاه شیمیدرمانی قبل از عمل پاسخ ندادهاند، میتوانند از اثرات سمی شیمیدرمانی طولانی مدت بعد از عمل با عواملی که تومور به آنها حساس نیست، در امان بمانند. در حال حاضر، هیچ مدرکی از مطالعات تصادفی کنترلشده فاز III برای تعیین نقش شیمیدرمانی قبل از عمل در سارکومهای بافت نرم در دسترس نیست. یک تجزیه و تحلیل گذشتهنگر از ۳۵۶ بیمار مبتلا به سارکومهای بافت نرم اندام با درجه بالا که در MSKCC انجام شد، نشان داد که شیمیدرمانی قبل از عمل (دوکسوروبیسین به همراه ایفوسفامید) بقای اختصاصی بیماری را در مقایسه با بقا در گروه جراحی تنها (HR 0.52، ۹۵٪ CI 0.30 تا ۰.۹۲؛ p = 0.02) پس از طبقهبندی بر اساس اندازه، بافتشناسی و سن بهبود بخشید. نویسندگان نتیجه گرفتند که شیمیدرمانی قبل از عمل در بیماران مبتلا به سارکومهای بافت نرم اندام با درجه بالا > ۱۰ سانتیمتر مفید است. گروه EORTC یک مطالعه فاز II انجام داد که ۱۵۰ بیمار مبتلا به سارکومهای بافت نرم پرخطر (تقریباً ۸۰٪ آنها در اندامها قرار داشتند) را به صورت تصادفی به یک گروه شیمیدرمانی قبل از عمل (دوکسوروبیسین به همراه ایفوسفامید، سه دوره) در مقابل یک گروه فقط درمان موضعی تقسیم کرد. پرتودرمانی پس از عمل بر اساس وضعیت حاشیه (<۱ سانتیمتر) صرف نظر از بازوی مطالعه تجویز شد. ۴۶٪ در گروه شیمیدرمانی و ۵۴٪ در گروه درمان موضعی-فقط، پرتودرمانی دریافت کردند. این مطالعه به دلیل روند کند افزایشی، قبل از گسترش به فاز سوم کارآزمایی بسته شد. اگرچه این مطالعه از قدرت کافی برخوردار نبود و مانع از نتیجهگیری قطعی میشد، اما نتوانست بهبود بقا را در افرادی که شیمیدرمانی قبل از عمل دریافت میکردند، نشان دهد. میزان بقای کلی ۵ ساله در گروه درمان موضعی-فقط ۶۴٪ و در گروه شیمیدرمانی ۶۵٪ بود (p = 0.22).
یک تجزیه و تحلیل گروهی از پایگاههای داده ترکیبی از MDACC و MSKCC برای ارزیابی اثربخشی شیمیدرمانی در سارکومهای بافت نرم درجه بالا انجام شد. دادههای مربوط به ۶۷۴ بیمار مبتلا به سارکوم اندام مرحله III که شیمیدرمانی مبتنی بر دوکسوروبیسین قبل یا بعد از عمل دریافت کرده بودند، برای تعیین پیامدهای آنها (بقای ۵ ساله مختص بیماری و همچنین میزان عود ۵ ساله موضعی و دوردست) بررسی شد. میزان بقای ۵ ساله مختص بیماری ۶۱٪ و احتمال عود موضعی و دوردست در ۵ سال به ترتیب ۸۳٪ و ۵۶٪ بود. نتیجهگیری مهم این مطالعه این بود که مزایای بالینی شیمیدرمانی مبتنی بر دوکسوروبیسین در بیماران مبتلا به سارکومهای اندام پرخطر، بیش از ۱ سال پس از درمان پایدار نبود. سپس محققان مطالعه خود را با همکاری متاآنالیز سارکوما مقایسه کردند و مشاهدات زیر را انجام دادند. اولاً، جمعیت بیماران همکاری متاآنالیز سارکوما ناهمگنتر از مطالعه کوهورت بود، به این معنی که شامل بیمارانی با سارکومهای اولیه و عودکننده اندام و غیر اندام بود. ثانیاً، متغیرهای کنترل نشده کمتری نیز در مطالعه کوهورت وجود داشت. بر اساس این یافتهها، نویسندگان هنگام بررسی مطالعات مربوط به رژیمهای شیمیدرمانی با پیگیری کوتاهمدت، احتیاط را توصیه کردند و نتیجه گرفتند که هنوز هیچ اجماعی در مورد نقش شیمیدرمانی در بیماران مبتلا به سارکومهای بافت نرم موضعی پرخطر وجود ندارد. همانطور که در نتایج مشاهده شد، میزان پاسخ به شیمیدرمانی احتمالاً با زیرگروه بافتشناسی مرتبط است. نشان داده شده است که برخی از زیرگروههای سارکوم، مانند سارکوم سینوویال، به شیمیدرمانی حساستر هستند. ایلبر و همکارانش از MSKCC یک بررسی گذشتهنگر ازدادههای جمعآوریشده آیندهنگر از 101 بیمار مبتلا به سارکوم سینوویال اندام T2b که تحت عمل جراحی قرار گرفته بودند، گزارش کردند.
شصت و هفت درصد از بیماران درمان مبتنی بر ایفوسفامید دریافت کردند (85٪ قبل از عمل) که با بهبود بقای اختصاصی بیماری همراه بود (4 سال، 88٪ در مقابل 67٪؛ p = 0.01). همین گروه همچنین یک مطالعه گذشتهنگر از 245 بیمار مبتلا به لیپوسارکومهای اندام درجه بالای T2 که تحت عمل جراحی رزکسیون قرار گرفتند، گزارش کردند. تقریباً نیمی (49٪) از بیماران سلول میکسوئید/گرد، 40٪ پلئومورفیک و 11٪ زیرگروه لیپوسارکوم تمایز نیافته داشتند. شصت درصد از بیماران شیمیدرمانی قبل یا بعد از عمل (مبتنی بر دوکسوروبیسین [34٪] یا مبتنی بر ایفوسفامید [26٪]) دریافت کردند. مشخص شد که شیمیدرمانی مبتنی بر ایفوسفامید با بهبود بقای 5 ساله مرتبط است (بقای اختصاصی بیماری 5 ساله، 92٪ در مقابل 65٪؛ p < 0.001)، در حالی که شیمیدرمانی مبتنی بر دوکسوروبیسین اینگونه نبود. در MDACC، ما رویکرد قبل از عمل را بر اساس دادههای موجود و مزایای نظری ذکر شده در بالا ترجیح میدهیم. الگوریتم درمانی استاندارد ما در شکل 5.3 شرح داده شده است. ما اغلب از شیمیدرمانی قبل از عمل و به دنبال آن پرتودرمانی در بیماران مبتلا به تومورهای بزرگ (T2) درجه بالا استفاده میکنیم. مطالعات آینده برای تعیین مزیت بقای این رویکرد و تعریف موثرترین رژیم درمانی ضروری است.
درمان پرفیوژن اندام ایزوله
در حالی که نجات اندام برای اکثر بیماران مبتلا به سارکوم بافت نرم امکانپذیر شده است، اما تقریباً در 5٪ از بیماران امکانپذیر نیست. درمان منطقهای با پرفیوژن اندام ایزوله (ILP) یا تزریق اندام ایزوله (ILI) در بیماران مبتلا به سارکوم پیشرفته برای حفظ اندام ارزیابی شده است. یکی از بزرگترین سریهای هلند از ILP به همراه فاکتور نکروز تومور-α (TNF-α) و ملفالان در 217 بیمار مبتلا به سارکوم بافت نرم استفاده کرد. میزان پاسخ گزارش شده 75٪ و میزان نجات اندام 87٪ بود. ILI، به عنوان یک روش جایگزین شیمیدرمانی موضعی، به همان اندازه مؤثر به نظر میرسد. واحد ملانوما سیدنی میزان پاسخ ۹۰٪ را در ۲۱ بیمار مبتلا به سارکوم با استفاده از ILI گزارش کرد که شامل ۶۵٪ از بیماران با پاسخ کامل بود. با این حال، میزان عود در این مطالعه، با میانگین پیگیری تنها ۲۸ ماه، ۴۲٪ بود. لازم به ذکر است که این مطالعات شامل تزریق TNF-α بود که در ایالات متحده در دسترس نیست. همانطور که انتظار میرفت، در این مرحله تفسیر نتایج برای این تکنیک دشوار است زیرا دادههای موجود نشان دهنده جمعیت کوچکی با بافتشناسی ناهمگن است که در آنها از عوامل و اندیکاسیونهای شیمیدرمانی متنوعی استفاده شده است.
مدیریت عود موضعی
بیماری میتواند تا ۲۰٪ از بیماران مبتلا به سارکوم اندام، معمولاً ظرف ۲ سال پس از برداشتن تومور، عود کند. عود موضعی با بقای کوتاهتر همراه است، اگرچه اینکه آیا عود موضعی علت بقای کوتاهتر است یا نشانگر بیماری تهاجمی است، بحثبرانگیز است. صرف نظر از این، کفایت برداشت جراحی به وضوح نقش مهمی در تعیین عود موضعی بیماری ایفا میکند.
عود موضعی منفرد باید به طور تهاجمی با برداشت کامل با حاشیه وسیع (10 تا 20 درصد از بیماران به دلیل درگیری ساختارهای حیاتی نیاز به قطع عضو دارند) به علاوه پرتودرمانی، که معمولاً قبل از عمل (به دلایلی که قبلاً مورد بحث قرار گرفت) در MDACC انجام میشود، درمان شود. استفاده از شیمیدرمانی قبل از عمل یا بعد از عمل به صورت موردی تعیین میشود. چندین مطالعه کوچک نشان دادهاند که بیماران مبتلا به عود موضعی منفرد ممکن است با موفقیت درمان مجدد شوند و میزان بقای بدون عود موضعی به 72 درصد نزدیک میشود. درمان بیمارانی که قبلاً تحت پرتودرمانی قرار گرفتهاند میتواند پیچیده باشد، زیرا پرتودرمانی مکرر عوارضی مانند اختلال در بهبود زخم، استئونکروز و فیبروز را افزایش میدهد که حتی میتواند به دلیل این عوارض منجر به قطع عضو در آینده شود. با این حال، برداشت وسیع ساده خطر بالایی از عدم موفقیت کنترل موضعی را به همراه دارد و قطع عضو همچنان یک گزینه برای ارائه کنترل موضعی کافی است. بیماران ممکن است برای براکیتراپی یا پرتودرمانی حین عمل در نظر گرفته شوند. استفاده از تکنیکهای جراحی پلاستیک مانند فلپهای بافت چرخشی برای برداشتن رادیکالتر و بهبود بهبود زخم توصیه میشود. ما تجربه خود را در مدیریت عود موضعی در بیمارانی که قبلاً در MDACC تحت پرتودرمانی قرار گرفته بودند، گزارش کردیم. از 62 بیمار در این مطالعه، 25 نفر فقط تحت عمل جراحی قرار گرفته بودند، در حالی که 37 نفر پس از برداشتن، پرتودرمانی پس از عمل (33 نفر تحت براکیتراپی) دریافت کرده بودند. میزان کنترل موضعی در 5 سال 51٪ بود. در تجزیه و تحلیل چند متغیره، حاشیههای مثبت با خطر بالاتر شکست موضعی همراه بود. پرتودرمانی پس از عمل، میزان کنترل موضعی (میزان 5 ساله: 58٪ در گروه پرتودرمانی در مقابل 39٪ در گروه جراحی تنها؛ p= 0.4) یا بقای اختصاصی بیماری (میزان 5 ساله، 66٪ در مقابل 67٪؛ p = 0.8) را بهبود نبخشید. میزان عوارض زخم در گروه پرتودرمانی به طور قابل توجهی بالاتر بود (80٪ در مقابل 17٪، p < 0.001). تفسیر این نتایج به دلیل سوگیری انتخاب دشوار است؛ با این حال، پزشکان معالج باید از خطر مرتبط با پرتودرمانی مجدد در بیماران مبتلا به سارکوم بافت نرم عودکننده آگاه باشند.
مدیریت بیماری دوردست
متاستازهای دوردست در ۴۰ تا ۵۰ درصد از بیماران مبتلا به سارکومهای اندام با درجه متوسط و بالا رخ میدهند. بیشتر متاستازها به مکانهای دوردست ظرف ۲ سال از تشخیص اولیه رخ میدهند و محل غالب متاستازهای دوردست از سارکومهای اولیه اندام، ریه است (بیش از ۷۰٪). درمان اصلی بیماری متاستاتیک، شیمیدرمانی سیستماتیک است، اما متاستازکتومی میتواند بقای بیماران منتخب را بهبود بخشد.
متاستازهای منفرد ریه باید برای برداشتن در نظر گرفته شوند اگر متاستازهای ریوی اضافی وجود نداشته باشد، بیمار از نظر پزشکی به اندازه کافی برای تحمل جراحی مناسب باشد و ضایعات قابل برداشتن باشند. مطالعات بزرگ، میزان بقای ۳ ساله ۴۰ تا ۵۰ درصد را در بیمارانی که متاستازهای ریوی آنها به طور کامل برداشته شده است، نشان دادهاند. در یک تحلیل چند متغیره از بیمارانی که تحت عمل جراحی برداشتن متاستازهای ریوی قرار گرفتند، مشخص شد که فاصله زمانی بیش از 12 ماه بدون بیماری، توانایی برداشتن تمام بیماریهای متاستاتیک، سن کمتر از 50 سال و عدم وجود عود موضعی قبلی، عوامل پیشآگهی مستقلی هستند.
سارکومهای اندام، توصیههای عمومی (شکل 5.3)
- تومورهای بافت نرم که در حال بزرگ شدن هستند یا قطر آنها بیش از 3 سانتیمتر است، باید با تصویربرداری رادیولوژیک (سونوگرافی، سیتیاسکن یا امآرآی) و تشخیص بافتی بر اساس یافتههای بیوپسی سوزنی ارزیابی شوند.
- ارزیابی بیماری متاستاتیک پس از تشخیص سارکوم: رادیوگرافی قفسه سینه برای ضایعات درجه پایین یا متوسط و تومورهای T1 و سیتیاسکن قفسه سینه برای تومورهای درجه بالا یا T2.
- برداشتن موضعی وسیع با حاشیه 2 سانتیمتر، درمان کافی برای ضایعات درجه پایین و تومورهای T1 است. ۴. پرتودرمانی نقش مهمی در مدیریت تومورهای T2 ایفا میکند.
- بیمارانی که سارکومهای عودکننده با درجه بالا یا بیماری متاستاتیک دوردست دارند، باید قبل یا بعد از عمل، شیمیدرمانی در نظر گرفته شوند.
- در درمان بیمارانی که عود موضعی منفرد یا متاستازهای دوردست قابل برداشت دارند، باید یک رویکرد جراحی تهاجمی اتخاذ شود.
سارکومهای رتروپریتونئال
در میان سارکومهای بافت نرم در بزرگسالان، ۱۵ تا ۲۰ درصد در رتروپریتونئوم رخ میدهند. اکثر تومورهای رتروپریتونئال بدخیم هستند و تقریباً یک سوم آنها سارکومهای بافت نرم هستند. تشخیص افتراقی در بیماری که با تومور رتروپریتونئال مراجعه میکند شامل لنفوم، تومورهای سلولهای زایا و کارسینومهای تمایز نیافته است. شایعترین RPSها عبارتند از لیپوسارکومها (50% تا 65%، عمدتاً لیپوسارکومهای تمایزیافته یا تمایززداییشده)، لیومیوسارکومها (20% تا 25%) و سارکومهای تمایزنیافته/طبقهبندینشده (که قبلاً به عنوان MFH طبقهبندی میشدند).
فراوانی بافتشناسی گزارششده در RPSها در مطالعات مختلف متفاوت است؛ با وجود این، بافتشناسی همچنان یک جزء کلیدی برای پیشآگهی کلی است. تجزیه و تحلیل یک پایگاه داده MDACC از 1118 بیمار مبتلا به RPS، تفاوتهای چشمگیری را در رفتار بین سه زیرگروه بافتشناسی (لیپوسارکوم تمایزیافته، سایر لیپوسارکومها [عمدتاً لیپوسارکوم تمایززداییشده] و سایر بافتشناسیها [عمدتاً لیومیوسارکوم و سارکومهای تمایزنیافته/طبقهبندینشده]) نشان داد. میزان بقای کلی ۵ ساله در لیپوسارکوم با تمایز خوب ۹۵٪، در سایر لیپوسارکومها ۲۵٪ و در سایر بافتشناسیها ۴۳٪ بود (p < 0.001). اهمیت زیرگروههای بافتشناسی در پیشبینی رفتار و بقای تومور همچنین توسط دو مطالعه گذشتهنگر بزرگ اخیر از MSKCC و گروه کاری RPS مشارکتی چند نهادی اروپایی گزارش شده است. بر اساس این گزارشها، لیپوسارکوم دارای میزان عود موضعی بالا (۳۵٪ تا ۶۰٪) و میزان متاستاز بالا در صورت تمایززدایی (۳۰٪) است، در حالی که لیومیوسارکوم دارای میزان متاستاز دوردست بالاتر (۶۰٪) و میزان عود موضعی پایین (<۲۰٪) است. این دو زیرگروه رایج RPS ویژگیهای متمایزی از یکدیگر دارند. استراتژیهای درمانی باید بر اساس بافتشناسی تومور توسط متخصصان چند رشتهای متخصص در سارکوم، فردیسازی شوند.
تظاهرات بالینی
RPSها عموماً به صورت تودههای بزرگ ظاهر میشوند؛ تقریباً ۵۰٪ از آنها در زمان تشخیص بزرگتر از ۲۰ سانتیمتر هستند. آنها معمولاً تا زمانی که به اندازه کافی بزرگ نشوند که ساختارهای مجاور را فشرده یا به آنها حمله کنند، علائمی ایجاد نمیکنند. در برخی موارد، بیماران ممکن است با علائم عصبی ناشی از فشرده شدن اعصاب کمری یا لگنی یا علائم انسدادی دستگاه گوارش ناشی از جابجایی یا درگیری مستقیم تومور در یک عضو روده مراجعه کنند.
ارزیابی
بررسی بیماری که توده خلف صفاق دارد با شرح حال دقیقی آغاز میشود که باید علائم و نشانههای لنفوم (مانند تب، تعریق شبانه) را رد کند. معاینه فیزیکی کامل با توجه ویژه به تمام حوزههای غدد لنفاوی و معاینه بیضه در مردان بسیار مهم است. ارزیابی آزمایشگاهی میتواند مفید باشد؛ افزایش سطح لاکتات دهیدروژناز میتواند نشاندهنده لنفوم باشد، در حالی که افزایش سطح گنادوتروپین جفتی انسانی بتا، سطح آلفا فتوپروتئین یا هر دو میتواند نشاندهنده تومور سلولهای زایا باشد. ارزیابی رادیولوژیک باید شامل سیتیاسکن شکم و لگن باشد تا وسعت تومور و ارتباط آن با ساختارهای اطراف، بهویژه ساختارهای عروقی، مشخص شود.
هدف از این روش، تعیین وسعت تومور و ارتباط آن با ساختارهای اطراف، به ویژه ساختارهای عروقی است. تصویربرداری باید شامل کبد در جستجوی متاستازها و بیماریهای شکمی ناپیوسته باشد. کلیهها نیز باید برای ارزیابی عملکرد کلیوی دو طرفه ارزیابی شوند.
سیتیاسکن قفسه سینه برای جستجوی متاستازهای ریه در بیماران مبتلا به تومورهای درجه بالا توصیه میشود. بیوپسی سوزنی با هدایت سیتیاسکن برای تشخیص بافت در بیمارانی که سابقه مبهم، تودهای با ظاهر غیرمعمول، تومور غیرقابل برداشت یا متاستاز دوردست دارند و در بیمارانی که به طور بالقوه واجد شرایط درمان قبل از عمل هستند، مناسب است.
جراحی
برداشتن کامل تومور با جراحی، اساس درمان تومورهای اولیه با حاشیههای منفی گسترده است. حاشیههای منفی گسترده اغلب به دلیل محدودیتهای آناتومیک امکانپذیر نیستند. در چندین ارزیابی گذشتهنگر از بیماران مبتلا به تومورهای با حاشیه منفی گسترده، برداشتن کامل تومور با جراحی (R0 یا R1) تنها در 40 تا 60 درصد از بیماران انجام شد. برداشتن ناقص یا کاهش حجم تومور (R2) ممکن است علائم موضعی را بهبود بخشد اما بقا را بهبود نمیبخشد. کیفیت برداشت جراحی برای نتایج مهم است. اولاً، برداشت حاشیهای مثبت، احتمال عود موضعی را افزایش میدهد. این امر حیاتی است زیرا عود موضعی اغلب علت مرگ و میر در RPS است. این موضوع توسط MDACC در مطالعهای روی ۸۳ بیمار تحت درمان با جراحی و رادیوتراپی نشان داده شده است. میزان کنترل موضعی پنج ساله پس از برداشت حاشیهای مثبت ۳۳٪ در مقابل ۶۲٪ پس از برداشت حاشیهای منفی بود (p = ۰.۰۱).
این مطالعه اهمیت عود موضعی را بیشتر برجسته میکند، زیرا از ۳۸ بیماری که بر اثر بیماری فوت کردند، عود موضعی تنها محل بیماری در ۱۶ بیمار (۴۲٪) و جزئی از پیشرفت در ۱۱ بیمار دیگر (۲۹٪) بود. ثانیاً، برداشت ناقص نیز با خطر ابتلا به متاستاز دوردست همراه بوده است که تقریباً چهار برابر بیشتر از افرادی است که تحت برداشت کامل قرار میگیرند. در نهایت، تأثیر مهمی بر بقا دارد. در تجزیه و تحلیل ۵۰۰ بیمار مبتلا به RPS که در MSKCC درمان شدند، میانگین مدت بقای بیمارانی که تحت عمل جراحی برداشتن کامل تومور قرار گرفتند، ۱۰۳ ماه در مقابل ۱۸ ماه برای بیمارانی بود که تحت عمل جراحی برداشتن ناقص تومور قرار گرفتند، که تفاوتی با بقای مشاهده شده در بیماران تحت درمان با مشاهده بدون برداشتن تومور نداشت، بنابراین نشان میدهد که هیچ مزیتی برای بقا از روشهای کاهش حجم تومور وجود ندارد.
برنامهریزی دقیق قبل از عمل هنگام بررسی برداشتن جراحی از اهمیت بالایی برخوردار است. برداشتن چند عضو اغلب برای دستیابی به برداشتن کامل تومور مورد نیاز است. تیمهای جراحی چند رشتهای اغلب ضروری هستند، مانند جراحی عروق، زمانی که برداشتن و/یا بازسازی عروق بزرگ مورد نیاز است.
میزان وسعت برداشتن جراحی، زمینهای از بحث و جدل فعال است. تعمیم مفهوم درمانی “برداشتن گسترده یا جزئی” از الگوریتم درمان سارکومهای اندام به درمان RPSها، به طور بالقوه منجر به برداشتن اندامهای مجاور غیر درگیر میشود. در یک مطالعه گذشتهنگر فرانسوی روی ۳۸۲ بیمار مبتلا به RPS که توسط Bonvalot و همکارانش گزارش شده است. در سال ۲۰۰۹، نفرکتومی در ۴۲٪ و کولکتومی در ۳۰٪ از بیماران انجام شد. میزان عود موضعی ۴۴٪ بود. نویسندگان از رزکسیون کمپارتمانال حمایت کردند که با بهبود کنترل موضعی همراه بود (میزان عود موضعی ۳.۲۹ برابر کمتر از رزکسیون کامل ساده). در بیمارانی که با چنین رویکردی درمان شدند، هیچ بهبودی در بقای کلی مشاهده نشد. علاوه بر این، میزان عوارض جراحی بالایی معادل ۱۶٪ گزارش شد. در نیمی از این بیماران، برای مدیریت عوارض، جراحی بیشتری لازم بود. در این مطالعه، سیزده بیمار (۳٪) در حین عمل و ۳ بیمار (۱٪) در حین عمل فوت کردند.
گرونچی و همکارانش از یک گروه ایتالیایی، تأثیر رزکسیون کمپارتمانال را در مقایسه با رزکسیون «استاندارد» بر اساس تغییر در «فلسفه» جراحی نهادی در طول زمان ارزیابی کردند. این مطالعه بیماران را بر اساس دوره زمانی، قبل و بعد از به کارگیری مفهوم رزکسیون گسترده در عمل، به دو گروه تقسیم کرد. پس از معرفی چنین رویکردی، بهبود مرتبطی در میزان عود موضعی از ۴۸٪ به ۲۸٪ (p = 0.007) مشاهده شد؛ با این حال، میزان متاستاز دوردست از ۱۳٪ به ۲۲٪ (p = 0.013) افزایش یافت، بدون اینکه تغییر آماری معنیداری در بقای کلی (میزان ۵ ساله، ۵۱٪ در مقابل ۶۰٪؛ p = 0.47) ایجاد شود. علاوه بر این، به دلیل ماهیت این طرح، بیماران در گروه برداشت گسترده، پیگیری بسیار کوتاهتری (تقریباً نصف) داشتند که ممکن است در تفاوت در عود موضعی نقش داشته باشد. محدودیتهای رویکرد برداشت گسترده یا “بخشی” مانع از پذیرش آن در عمل بالینی شده است. RPSها معمولاً بزرگ هستند و اندامهای متعددی را در همه جهات در مجاورت خود قرار میدهند. برداشت چند احشایی، اگرچه اغلب ضروری است، اما عوارض و مرگ و میر مرتبط با برداشت را به طور قابل توجهی افزایش میدهد، احتمالاً به صورت تصاعدی. این امر توجیه برداشت اندامهای “مجاور” غیر درگیر (مانند کلیه، پانکراس، دوازدهه) را دشوار میکند.
بنابراین، عمل ما این است که ساختارهای مجاور با شواهد تهاجم، چه از طریق رادیوگرافی و چه در زمان کاوش جراحی، را برداریم. ساختارهایی که به وضوح توسط تومور مورد تهاجم قرار نگرفتهاند، حفظ میشوند (شکل 5.4).
درمان چندوجهی
میزان بالای عود موضعی و دوردست در RPS منجر به تغییر در استراتژیهای درمانی برای RPS موضعی به سمت درمان چندوجهی، مانند استفاده از شیمیدرمانی و/یا پرتودرمانی در حین عمل، شده است.
به دلیل نادر بودن RPSها، هیچ مدرک سطح I وجود ندارد که به طور قطعی از نقش پرتودرمانی یا شیمیدرمانی برای RPS موضعی حمایت کند.
استفاده از شیمیدرمانی یا پرتودرمانی در حین عمل در RPS برای بهبود پیامد استفاده شده است، که عمدتاً بر اساس دادههای حاصل از مطالعات گذشتهنگر محدود بیماران RPS و دادههای استخراج شده از موارد سارکوم اندام، همانطور که در بخشهای قبلی توضیح داده شد، میباشد.
پرتودرمانی
چندین مطالعه گذشتهنگر، مزایای پرتودرمانی پس از عمل را گزارش کردهاند. با این حال، اغلب ارائه پرتودرمانی به RPSها پس از عمل، حتی با تکنیکهای پیشرفتهای مانند IMRT، دشوار است، زیرا روده و سایر اندامها اغلب در ناحیه برداشته شده قرار دارند.
روند فعلی برای درمان RPSها با پرتودرمانی، رویکرد قبل از عمل است، زیرا تومور اغلب اندامهای حساس به پرتو مجاور را جابجا میکند. اعتقاد بر این است که با استفاده از IMRT، پرتودرمانی قبل از عمل، قرار گرفتن در معرض تابش به ساختارهای طبیعی را به حداقل میرساند و در عین حال امکان تابش متمرکز تومور را فراهم میکند (شکل 5.5).
محققان MDACC و همکارانش از تورنتو، دادههایی از دو کارآزمایی آیندهنگر را گزارش کردند که اثرات پرتودرمانی قبل از عمل را در RPS بررسی کردند. در مجموع 72 بیمار مبتلا به RPS با درجه متوسط یا بالا (40٪ لیپوسارکوم، 26٪ لیومیوسارکوم و 15٪ MFH) با پرتودرمانی قبل از عمل درمان شدند. تنها دو بیمار (3٪) دوز تابش برنامهریزی شده را کامل نکردند، که از امکانسنجی رویکرد قبل از عمل پشتیبانی میکند. علیرغم اینکه فقط بیماران پرخطر در این مطالعه گنجانده شده بودند، این مطالعه با نرخ بقای ۵ ساله بدون عود موضعی ۶۰٪ و نرخ برداشت کامل ۹۵٪ به نتایج مطلوبی دست یافت.
 |
| شکل 5.4 تصویربرداری مقطعی که میزان برداشت توسط (الف) برداشت سنتی با حفظ عضو را در مقایسه با (ب) برداشت “کمپارتمانتال” گسترده نشان میدهد. وضعیت حاشیه برداشت، صرف نظر از میزان برداشت، در سطح آئورت، ستون فقرات و دیواره بدن محدود خواهد بود. |
 |
| شکل ۵.۵ تصویربرداری از برنامهریزی پرتودرمانی با شدت تعدیلشده، که یک سارکوم بزرگ خلف صفاقی را هدف قرار میدهد. |
یکی دیگر از ملاحظات شامل رویکرد ترکیبی پرتودرمانی قبل از عمل با پرتودرمانی حین عمل است. استاکی و همکارانش از کلینیک مایو-آریزونا نتایج یک مطالعه گذشتهنگر از ۶۳ بیمار (۳۷ نفر که تحت پرتودرمانی قبل از عمل، جراحی، به علاوه پرتودرمانی حین عمل و ۲۶ نفر که فقط جراحی داشتند) را گزارش کردند. پرتودرمانی با بهبود نرخ کنترل موضعی ۵ ساله (۸۹٪ در مقابل ۴۶٪ در گروه جراحی به تنهایی؛ p = ۰.۰۳) همراه بود که پس از تجزیه و تحلیل چند متغیره معنیدار باقی ماند. هیچ تاثیری بر بقای کلی وجود نداشت.
براکیتراپی بعد از عمل در ترکیب با پرتودرمانی قبل از عمل موثر نشان داده نشده است. اسمیت و همکارانش پیگیری طولانیمدت یک کارآزمایی فاز II از ۴۰ بیمار مبتلا به RPS را که پرتودرمانی قبل از عمل را با یا بدون براکیتراپی بعد از عمل دریافت کرده بودند، گزارش کردند. براکیتراپی اضافی با مشخصات سمیت غیرقابل قبول همراه بود که معمولاً با دوازدهه/تنگی دوازدهه و مرگ همراه بود. نه بقای بدون عود و نه بقای کلی در بیمارانی که براکیتراپی اضافی دریافت کردند، بهبود نیافت. نوسباوم و همکارانش اخیراً نتایج تحلیلهای تطبیقشده با امتیاز تمایل بیماران مبتلا به RPS را از پایگاه داده ملی سرطان گزارش کردند. این مطالعه ۵۶۳ بیمار که قبل از عمل جراحی دریافت کرده بودند یا ۲۲۱۵ بیمار که بعد از عمل پرتودرمانی دریافت کرده بودند را با ۶۲۹۰ بیمار که پرتودرمانی دریافت نکرده بودند، مقایسه کرد. این مطالعه نشان داد که پرتودرمانی، چه با رویکرد قبل از عمل جراحی و چه بعد از عمل جراحی، بقای کلی را در مقایسه با جراحی به تنهایی بهبود میبخشد (قبل از عمل: HR 0.7، ۹۵٪ CI 0.59 تا ۰.۸۲؛ p < 0.70؛ بعد از عمل جراحی: HR 0.78، ۹۵٪ CI 0.71 تا ۰.۸۵؛ p < 0.001). در حال حاضر، EORTC در حال انجام یک مطالعه فاز III تصادفی آیندهنگر (EORTC 62092، کارآزمایی STRASS؛ NCT01344018) است که پرتودرمانی قبل از عمل جراحی (۵۰.۴ گری در ۲۸ جلسه) به همراه جراحی را با جراحی به تنهایی مقایسه میکند. وقتی این کارآزمایی تکمیل شود، ممکن است نقش پرتودرمانی قبل از عمل در RPS را بهتر تعریف کند. نتایج در سال 2020 انتظار میرود.
شیمیدرمانی
دادههای مربوط به شیمیدرمانی بعد از عمل یا قبل از عمل در RPS بسیار محدود است. اخیراً، گروهی از کالج پزشکی ویسکانسین دادههایی را از پایگاه داده ملی سرطان گزارش کردهاند. از 8653 بیمار مبتلا به RPS که با جراحی برداشته شدهاند، 1525 نفر (18٪) شیمیدرمانی قبل از عمل (11٪) یا بعد از عمل (7٪) دریافت کردند. بیمارانی که تومورهای آنها به عنوان درجه متوسط/بالا، لیومیوسارکوم یا بافتشناسی UPS و وضعیت برداشتن R2 طبقهبندی شده بود، بیشتر شیمیدرمانی دریافت کردند. پس از تطبیق نمره تمایل، میانگین OS در بیمارانی که شیمیدرمانی دریافت کردند کوتاهتر بود (40 در مقابل 52 ماه؛ p = 0.002). دو مطالعه گذشتهنگر مشابه دیگر، که توسط Singer و همکاران در سال 1995 و Bremjit و همکاران در سال 2014 گزارش شده است، پیامدهای نامطلوب مرتبط با شیمیدرمانی بعد از عمل یا قبل از عمل در RPS را نشان دادند. با این حال، به دلیل سوگیری انتخاب ذاتی مرتبط با این مطالعات گذشتهنگر، ارزیابی قطعی نقش شیمیدرمانی در RPS دشوار است.
MDACC در یک مطالعه گذشتهنگر بر روی 309 بیمار مبتلا به سارکوم اولیه بافت نرم، از جمله 108 مورد واقع در رتروپریتونئوم/احشاء، ایمنی شیمیدرمانی قبل از عمل را گزارش کرد. شیمیدرمانی قبل از عمل، میزان عوارض جراحی را در بیماران مبتلا به RPS افزایش نداد (29٪ در مقابل 34٪ در گروه جراحی اولیه؛ p = 0.66). MDACC همچنین تأثیر پاسخ رادیوگرافی به شیمیدرمانی قبل از عمل را بر میزان برداشت جراحی ارزیابی کرد. در این مطالعه گذشتهنگر بر روی 65 بیمار مبتلا به سارکوم مرحله II یا III (23 نفر رتروپریتونئال) که با شیمیدرمانی قبل از عمل درمان شدند، پاسخ رادیوگرافی برای کاهش میزان جراحی در 13٪ کافی بود. بیمارانی که پاسخ رادیوگرافی داشتند، میزان برداشت حاشیه منفی بالاتر، میزان بقای بدون عود موضعی بهتر و میزان بقای کلی بهتری نسبت به افراد غیرپاسخگو داشتند. روش کار ما تعیین استراتژیهای درمانی برای بیماران مبتلا به RPS در یک کنفرانس سارکوم چند رشتهای است. ما با دقت از شیمیدرمانی و/یا پرتودرمانی قبل از عمل استفاده میکنیم، معمولاً در بیمارانی که سارکومهای بافت نرم دارند و در معرض خطر بالای متاستاز دوردست هستند، مانند بافتشناسی متوسط یا درجه بالا و تومورهای بزرگ یا عودکننده.
بیوپسی قبل از درمان و تأیید بافتشناسی قبل از شروع هرگونه درمان قبل از عمل برای RPS الزامی است. رایجترین رژیم مورد استفاده، دوکسوروبیسین به همراه ایفوسفامید است که توسط دادههای حاصل از مطالعات سارکومهای بافت نرم اندامها پشتیبانی میشود. رویکرد قبل از عمل به دلایل مختلفی ترجیح داده میشود که در بخش قبلی توضیح داده شد. علاوه بر ملاحظات قبلی، در بیماران مبتلا به RPS که کلیه را درگیر میکنند، برنامهریزی چند رشتهای قبل از عمل بسیار مهم است زیرا تجویز ایفوسفامید به دلیل نفروتوکسیسیتی بالقوه به دو کلیه نیاز دارد.
درمان هدفمند
توسعه درمانهای هدفمند ممکن است اثربخشی درمان سیستمیک برای سارکومهای بافت نرم را در آینده بهبود بخشد. یکی از این درمانها که در حال بررسی است، مهارکنندههای CDK4، یک کیناز وابسته به سیکلین است که اغلب در لیپوسارکومها بیش از حد بیان میشود. دیکسون و همکارانش از MSKCC اخیراً نتایج یک کارآزمایی فاز II از یک مهارکننده CDK4 را که به 60 بیمار مبتلا به لیپوسارکوم (47 بیمار تمایز نیافته و 13 بیمار تمایز یافته) تجویز شده بود، منتشر کردند. آنها یک پاسخ کامل را گزارش کردند که بیش از 2 سال طول کشید. بقای کلی بدون پیشرفت در 12 هفته 57٪ بود. مهارکنندههای MDM2 برای درمان لیپوسارکومها نیز در حال بررسی هستند.
درمان بیماری عودکننده
RPSها پس از برداشتن کامل جراحی، در دو سوم بیماران، عود میکنند. لیومیوسارکومهای خلف صفاق علاوه بر عود موضعی در بستر تومور و متاستاز به ریهها، اغلب به کبد و بافتهای نرم گسترش مییابند. RPSها همچنین میتوانند به صورت منتشر در سراسر حفره صفاقی عود کنند (سارکوماتوز). هر عود موضعی نه تنها بر درمان جراحی تأثیر میگذارد، بلکه میتواند با تغییر در زیستشناسی بیماری نیز مرتبط باشد. برای مثال، در حدود ۲۵٪ از بیماران، لیپوسارکوم با تمایز خوب ممکن است به شکلی با تمایز ضعیف عود کند یا نواحی از تمایززدایی ایجاد کند. لیپوسارکوم خلف صفاقی تمایززدایی شده، تهاجمیتر است و تمایل بیشتری به متاستاز دوردست نسبت به پیشساز با تمایز خوب خود دارد.
رویکرد به بیماری عودکننده قابل برداشت پس از درمان RPS مشابه رویکردی است که پس از عود سارکوم اندام انجام میشود. با این حال، توانایی برداشت کافی RPS عودکننده با هر عود به سرعت کاهش مییابد. یک مزیت بقا از جراحی نجات برای RPS عودکننده گزارش شده است، اما انتخاب دقیق بیمار بسیار مهم است.
پارک و همکارانش از MSKCC نتایج یک تجزیه و تحلیل گذشتهنگر از ۱۰۵ بیمار مبتلا به اولین لیپوسارکوم خلف صفاقی عودکننده را گزارش کردند که ۶۱ نفر از آنها تحت برداشت نجاتبخش قرار گرفتند. اندازه و سرعت رشد تومور عودکننده به طور مستقل با بروز عود موضعی دوم مرتبط بود. تومور عودکننده با نرخ رشد > 0.9 سانتیمتر در ماه با پیامد ضعیفتری همراه بود و نویسندگان نتیجه گرفتند که بیماران مبتلا به تومورهایی از این دست باید در کارآزماییهای بالینی ثبتنام شوند تا اینکه تحت عمل جراحی مجدد قرار گیرند.
برداشتن ضایعات متاستاتیک نیز میتواند در بیماران منتخب در نظر گرفته شود. به عنوان مثال، گزارش شده است که بیماران مبتلا به لیومیوسارکوم پس از برداشتن متاستاز دوردست، در مقایسه با سایر زیرگروهها، بقای بهتری دارند. بنابراین، بیمارانی که لیومیوسارکوم خلف صفاقی عودکننده دوردست دارند، گاهی اوقات برای متاستازکتومی در نظر گرفته میشوند. در تجزیه و تحلیل اخیر ما در MDACC، فاصله زمانی بدون بیماری بیش از 1 سال از برداشتن اولیه تا عود با پیامدهای بهبود یافته پس از جراحی نجات همراه بود.
تومورهای استرومایی دستگاه گوارش
GISTها اکثر تومورهای مزانشیمی دستگاه گوارش را تشکیل میدهند که تخمین زده میشود 2500 تا 6000 مورد در سال در ایالات متحده باشد. اگرچه تظاهرات بالینی این تومورها بسته به اندازه تومور و محل آناتومیک متفاوت است، اما بیشتر تومورها به طور اتفاقی در زمان آندوسکوپی یا تصویربرداری رادیولوژیک یافت میشوند. تومورهای استرومایی معده (GIST) اغلب در معده (60٪ تا 70٪) و پس از آن در روده کوچک (20٪ تا 25٪)، روده بزرگ و راست روده (5٪) و مری (کمتر از 5٪) ایجاد میشوند.
بیشتر تومورهای استرومایی معده (GIST) پراکنده و در 95٪ موارد، منفرد هستند. اکثر بیماران مبتلا به GIST در دهههای پنجم تا هفتم زندگی مراجعه میکنند و این تومورها به طور مساوی بین دو جنس توزیع شدهاند. علائم این ضایعات شامل درد و خونریزی دستگاه گوارش است و توده شکمی یک یافته شایع است.
از اواخر دهه 1990، تومورهای استرومایی معده (GIST) به عنوان تومورهایی با ویژگیهای ایمونوهیستوشیمی و ژنتیکی متمایز شناخته شدهاند. GISTها از سلولهای ضربانساز روده (سلولهای بینابینی کاخال) منشأ میگیرند که CD117، یک گیرنده تیروزین کیناز غشایی که محصول پروتوانکوژن c-KIT است، را بیان میکنند. بیان CD117 که حداقل در 95٪ موارد یافت میشود، به عنوان یک ویژگی مهم و تعیینکننده GISTها ظاهر شده است. پاتوژنز این تومورها مربوط به جهش در ژن c-KIT است. بهرهبرداری از این ویژگی ژنتیکی منجر به پیشرفتهای قابل توجهی در توسعه درمان موفقیتآمیز برای این تومورها شده است.
درمان
GISTها نمونهای از قدرت درمان هدفمند در درمان سرطان است. در گذشته، برداشتن جراحی تنها درمان GISTها بود. اگرچه جراحی همچنان درمان استاندارد برای تومورهای قابل برداشت است، اما افزودن درمان سیستمیک به طور قابل توجهی نتیجه را بهبود بخشیده است.
هدف از جراحی باید برداشتن با حاشیه 1 تا 2 سانتیمتر در صورت امکان باشد. برای تومورهای واقع در معده، برداشتن گوهای اغلب میتواند به این هدف دست یابد. تکنیکهای کمتهاجمی معمولاً در مدیریت GISTها استفاده میشوند. در مواردی که تومورهای بزرگ وجود دارد، درمان قبل از عمل با یک مهارکننده تیروزین کیناز (TKI) باید برای کاهش اندازه تومور در نظر گرفته شود، که ممکن است به اندازهای کوچک شود که میزان برداشتن جراحی را تغییر دهد. با این حال، علیرغم برداشتن کامل، عود در تومورهای پرخطر رایج است.
عواملی مانند اندازه بزرگ تومور (>5 سانتیمتر)، محل تومور در دوازدهه یا رکتوم، تعداد میتوزی بالای بیش از 5 میتوز در 50 میدان با قدرت بالا، و وضعیت جهش (مانند حذف در اگزون 9 KIT) با افزایش خطر عود همراه هستند. در مقابل، تومورهای GIST کوچک (≤2 سانتیمتر) با میزان میتوزی پایین ≤5 میتوز در 50 میدان با قدرت بالا، که در معده قرار دارند، با خطر کم پیشرفت بیشتر تومور همراه هستند و میتوان آنها را با نظارت آندوسکوپی سریال (فواصل 6 تا 12 ماه) مشاهده کرد (دستورالعملهای NCCN نسخه 2.2014).
توسعه ایماتینیب (گلیوک) بقای بیماران مبتلا به تومورهای استرومایی دستگاه گوارش (GISTs) را به میزان قابل توجهی افزایش داده است. ایماتینیب یک مهارکننده کیناز انتخابی c-KIT و گیرنده آلفای فاکتور رشد مشتق از پلاکت (PDGFR-α) است. ایماتینیب در سال 2002 توسط سازمان غذا و داروی ایالات متحده پس از اتمام موفقیتآمیز آزمایشهایی که بیماران مبتلا به بیماری متاستاتیک و پیشرفته موضعی را ثبت نام کرده بودند، تأیید شد (جدول 5.3). میزان پاسخ کلی 48 تا 71 درصد بود و میانگین بقای کلی در بیماران مبتلا به تومورهای استرومایی دستگاه گوارش پیشرفته که با ایماتینیب درمان شدند، 57 ماه در مقایسه با 9 ماه در گروه کنترل بود. ژنوتیپ جهش c-KIT مهم است: بیمارانی که جهش در اگزون 11 داشتند، میزان پاسخ بالاتری نسبت به بیماران دارای جهش در اگزون 9 داشتند، اگرچه هر دو گروه نسبت به بیماران بدون جهش (نوع وحشی) پاسخ بهتری داشتند. فایدهی ایماتینیب در شرایط پس از عمل در یک کارآزمایی تصادفی کنترلشده (ACOSOG Z9001) که 713 بیمار مبتلا به جهشهای GIST و KIT را پس از برداشتن کامل تومور از طریق جراحی ثبت نام کرده بود، نشان داده شد. بیمارانی که به مدت 1 سال روزانه 400 میلیگرم گلیوک دریافت کردند، بقای بدون عود بهتری نسبت به گروه دارونما داشتند (98٪ در مقابل 83٪؛ p < 0.001). مدت زمان مطلوب درمان پس از عمل در یک کارآزمایی تصادفی دیگر با ایماتینیب پس از عمل با دوز 400 میلیگرم در روز به مدت 12 ماه در مقابل 36 ماه بررسی شد. نتایج، برتری استفاده از درمان طولانی مدت (36 ماه) ایماتینیب پس از عمل را نشان داد (میزان بقای 5 ساله، 92٪ در مقابل 82٪؛ p = 0.02). به دلیل موفقیت درمان ایماتینیب پس از عمل برای بیماریهای قابل برداشت و میزان پاسخ بالای گزارش شده به ایماتینیب در بیماری پیشرفته، ایماتینیب به طور فزایندهای در شرایط قبل از عمل نیز مورد استفاده قرار گرفته است. کارآزمایی فاز دوم RTOG 0132/ACRIN 6665 که 63 بیمار مبتلا به GIST با KIT مثبت را ثبتنام کرد، گزارش داد که 7٪ از بیماران پاسخ عینی به ایماتینیب قبل از عمل (6 تا 8 هفته) داشتند و بیماری پایدار در 83٪ حاصل شد. در حالی که این مطالعه در مورد ایمنی درمان با ایماتینیب قبل از عمل گزارش داده است، Tirumani و همکارانش گزارش دادند که حداکثر پاسخ تومور معمولاً پس از 3 تا 9 ماه مشاهده میشود، که در آن زمان باید جراحی انجام شود. با این حال، حتی در بیمارانی که جهش KIT دارند، 5٪ هنوز میتوانند مقاومت اولیه به ایماتینیب نشان دهند و 14٪ در زمانهای بعدی مقاومت ایجاد میکنند. Sunitinib، یکی دیگر از مهارکنندههای تیروزین کیناز با اهداف متعدد از جمله KIT، PDGFR و VEGFR با ویژگیهای اتصال متفاوت نسبت به ایماتینیب، میتواند به عنوان درمان خط دوم در مواردی که به ایماتینیب پاسخ نمیدهند یا مقاومت ایجاد میکنند، در نظر گرفته شود.
| جدول5.3خلاصهای از کارآزماییهای بالینی ایماتینیب مزیلات در بیماران مبتلا به تومور استرومایی پیشرفته دستگاه گوارش |
 |
سایر سارکومهای بافت نرم
سارکوم پستان
سارکومهای پستان تومورهای نادری هستند که کمتر از 1٪ از کل بدخیمیهای پستان و کمتر از 5٪ از کل سارکومهای بافت نرم را تشکیل میدهند. زیرگروههای بافتشناسی مختلفی در پستان رخ میدهند، از جمله آنژیوسارکوم، سارکوم استرومایی، فیبروسارکوم و سارکومهای تمایز نیافته/طبقهبندی نشده. سیستوسارکوم فیلودس عموماً به عنوان یک موجود جداگانه از سایر سارکومهای بافت نرم در نظر گرفته میشود، زیرا اعتقاد بر این است که این تومورها از سلولهای استرومایی پستان که به هورمونها پاسخ میدهند، منشأ میگیرند و اکثر آنها خوشخیم هستند. مانند سارکومها در سایر نقاط آناتومیک، درجه هیستوپاتولوژیک و اندازه تومور از عوامل پیشآگهی مهم هستند. برداشتن کامل با حاشیههای منفی درمان اصلی است. اگر برداشتن کامل با ماستکتومی سگمنتال امکانپذیر باشد، ماستکتومی کامل هیچ مزیت اضافی ندارد. به دلیل میزان پایین گسترش لنفاوی منطقهای، ارزیابی غدد لنفاوی زیر بغل به طور معمول توصیه نمیشود. شیمیدرمانی یا پرتودرمانی قبل از عمل ممکن است برای بیمارانی که تومورهای بزرگ و پرخطر دارند، در نظر گرفته شود.
تومورهای دسموئید
تومورهای دسموئید متاستاز نمیدهند و سارکومهای درجه پایین محسوب میشوند. تقریباً نیمی از این تومورها در اندامها ایجاد میشوند و بقیه از تنه، دیواره شکم یا شکم/خلف صفاق (از جمله مزانتر) منشأ میگیرند. دسموئیدهای دیواره شکم اغلب با بارداری مرتبط هستند و اعتقاد بر این است که در نتیجه تأثیرات هورمونی ایجاد میشوند. بیماران مبتلا به سندرم گاردنر نسبت به جمعیت عادی، خطر بیشتری برای تومورهای دسموئید مزانتریک/خلف صفاق، به عنوان یک تظاهر خارج روده بزرگ، دارند. دسموئیدهایی که کوچک، بدون علامت و در یک محل مناسب (سطحی) هستند، میتوانند در ابتدا با مشاهده مدیریت شوند. برداشتن جراحی با برداشتن موضعی وسیع باید درمان اولیه برای تومورهای دسموئید باشد. با این حال، عود موضعی ممکن است در حداکثر یک سوم بیماران رخ دهد. پرتودرمانی پس از عمل، در بیمارانی که حاشیههای R1 دارند و دستیابی به حاشیههای منفی در آنها منجر به عوارض بیش از حد میشود، با کاهش بروز عود موضعی همراه بوده است. برای دسموئیدهایی که قابل جراحی نیستند یا جراحی به طور غیرقابل قبولی عوارض ایجاد میکند، پرتودرمانی قطعی نیز میتواند رشد تومور را برای مدت طولانی کنترل کند و باید در نظر گرفته شود. درمان سیستمیک با سولینداک یا سایر داروهای ضد التهابی غیر استروئیدی از جمله سلکوکسیب، تاموکسیفن یا تورمیفن، و همچنین درمانهای تهاجمیتر مانند شیمیدرمانی مبتنی بر دوکسوروبیسین، ایماتینیب یا سورافنیب را میتوان برای پیشرفت یا عود بیماری در نظر گرفت. تومورهای دسموئید پیشرونده یا عودکننده را میتوان با درمان سیستمیک، رزکسیون به همراه پرتودرمانی یا پرتودرمانی قطعی (در صورتی که قبلاً تحت تابش قرار نگرفته باشند) درمان کرد. پیگیری روتین با تصویربرداری مناسب هر 3 تا 6 ماه به مدت 2 سال و سپس سالانه برای ارزیابی عود توصیه میشود.
درماتوفیبروسارکوم پروتوبرانس
درماتوفیبروسارکوم پروتوبرانس یک نئوپلاسم است که در پوست ایجاد میشود و ممکن است در هر جایی از بدن رخ دهد. تقریباً 40٪ از آنها در تنه ایجاد میشوند و بیشتر تومورهای باقی مانده بین سر و گردن و اندامها توزیع شدهاند. این ضایعه به صورت یک توده پوستی ندولار ظاهر میشود که رشد آهسته و مداومی را نشان میدهد. ضایعات ماهوارهای ممکن است در بیمارانی با تومورهای بزرگتر یافت شوند. برداشتن موضعی وسیع، در حالت ایدهآل با حاشیه 2 سانتیمتر توصیه میشود. میزان عود میتواند تا 50٪ باشد. در صورت عدم امکان انجام برداشتن مجدد بیشتر، پرتودرمانی برای حاشیههای مثبت توصیه میشود. در تجزیه و تحلیل ژنتیکی، ژن/پروتئین فیوژن COL1A1-PDGFB اغلب تشخیص داده میشود. این امر از اهمیت بالینی برخوردار است زیرا برخی از بیماران مبتلا به درماتوفیبروسارکوم پروتوبرانس متاستاتیک به ایماتینیب، یک مهارکننده کیناز PDGFR، پاسخ دادهاند. اگر تغییر فیبروسارکوماتوز در بررسی پاتولوژیک مشاهده شود، تومورها باید به عنوان سارکومهای بافت نرم درجه بالا در نظر گرفته شوند و به همین ترتیب درمان شوند.
سارکوم استخوان
استئوسارکوم و سارکوم یوئینگ دو مورد از شایعترین بیماریهای بدخیم استخوان هستند. استئوسارکوم در دوران رشد نوجوانان بیشترین فراوانی را دارد، در حالی که سارکوم یوئینگ بیشتر در دهه دوم زندگی رخ میدهد. شایعترین تظاهر سارکومهای استخوانی (سارکوم یوئینگ یا استئوسارکوم) درد یا تورم در استخوان یا مفصل است. همانند سارکومهای بافت نرم در بزرگسالان، اغلب یک حادثه آسیبزا توجه را به تورم جلب میکند و میتواند تشخیص صحیح را به تأخیر بیندازد. استئوسارکوم معمولاً متافیز استخوانهای بلند، به ویژه انتهای تحتانی استخوان ران، انتهای فوقانی استخوان ساق پا یا استخوان بازو را درگیر میکند. سارکوم یوئینگ ممکن است استخوانهای صاف یا دیافیز استخوانهای لولهای مانند استخوان ران، لگن، ساق پا و نازکنی را درگیر کند.
سارکوم یوئینگ همچنین ممکن است در بافتهای نرم رخ دهد. کندروسارکوم بیشتر در لگن، پروگزیمال فمور و کمربند شانهای رخ میدهد. تا 25٪ از بیمارانی که با استئوسارکوم یا سارکوم یوئینگ مراجعه میکنند، در زمان مراجعه بیماری متاستاتیک دارند. شایعترین محلهای متاستاتیک برای استئوسارکوم شامل ریه (بیش از 90٪) و استخوان (10٪) است، در حالی که متاستازهای سارکوم یوئینگ در ریه (50٪)، استخوان (25٪) و مغز استخوان (25٪) رخ میدهد.
مرحلهبندی
همانند سارکومهای بافت نرم، درجه هیستوپاتولوژیک جزء حیاتی مرحلهبندی سارکومهای استخوانی است. سیستم مرحلهبندی جراحی برای سارکوم اسکلتی-عضلانی بر اساس سیستم Enneking است که شامل متغیرهای پیشآگهی درجه هیستوپاتولوژیک (G)، محل تومور (T) و وجود متاستاز (M) میشود. سه مرحله عبارتند از مرحله I (درجه پایین)، مرحله II (درجه بالا) و مرحله III (متاستاتیک). مراحل I و II در صورتی که ضایعه در محدوده جراحی مشخص باشد، A (مثلاً مرحله IA) و در صورتی که ضایعه تهاجم خارج از محدوده داشته باشد، B نامیده میشوند.
تشخیص
ارزیابی بیماران مشکوک به تومور استخوانی باید شامل شرح حال و معاینه فیزیکی، رادیوگرافی ساده و MRI از کل استخوان آسیبدیده باشد. اسکن استخوان و سیتیاسکن قفسه سینه نیز ضروری است. در رادیوگرافیهای ساده، تومورهای بدخیم استخوان مرزهای نامنظمی را نشان میدهند و اغلب شواهدی از تخریب استخوان و واکنش پریوست وجود دارد. گسترش بافت نرم نیز اغلب مشاهده میشود. بیوپسی با سوزن هسته، روش تشخیصی انتخابی در موارد مشکوک به استئوسارکوم است. بیوپسی با سوزن هسته که تحت هدایت رادیوگرافی انجام میشود، تقریباً در همه موارد استئوسارکوم، یافتههای تشخیصی را به همراه خواهد داشت.
درمان
درمان چندوجهی مؤثر برای تومورهای اسکلتی-عضلانی دوران کودکی برای بهبود بقا بسیار مهم است.
جراحی
در صورت امکان، نجات اندام، رویکرد جراحی استاندارد برای سارکومهای استخوان است. جراحی موفقیتآمیز با حفظ اندام شامل سه مرحله است: برداشتن تومور، بازسازی استخوان و پوشش بافت نرم. برداشتن کامل تومور اولیه و هرگونه متاستاز از طریق جراحی ضروری است، به ویژه در استئوسارکوم زیرا در برابر پرتودرمانی نسبتاً مقاوم است. همچنین برداشتن سارکوم یوئینگ مطلوب است. اگر برداشتن جراحی با حاشیه جراحی وسیع امکانپذیر باشد، پیشآگهی مطلوب است (میزان بقای 12 ساله بدون عود 60٪). با این حال، سارکوم یوئینگ معمولاً لگن را درگیر میکند و تودهای از بافت نرم گسترده به حفره لگن حمله میکند که جراحی رادیکال را دشوار میکند. برداشتن تومور با جراحی معمولاً تنها درمانی است که برای مدیریت کندروسارکومها توصیه میشود زیرا این نوع تومور به درمانهای سیستمیک موجود پاسخ نمیدهد.
شیمی درمانی
شیمی درمانی انقلابی در درمان اکثر سارکومهای استخوان ایجاد کرده و به عنوان مراقبت استاندارد برای استئوسارکوم و سارکوم یوئینگ در نظر گرفته میشود. میزان بقای ناامیدکننده ۱۵ تا ۲۰ درصدی با جراحی به تنهایی در دهه ۱۹۶۰، با افزودن شیمی درمانی به برداشتن جراحی، در گزارشهای جدیدتر به ۵۵ تا ۸۰ درصد بهبود یافته است. شیمی درمانی قبل از عمل گزینه جذابی است زیرا میتواند منجر به کاهش مرحله تومورها شود که در نتیجه امکان استفاده حداکثری از جراحی بدون حفظ اندام را فراهم میکند. علاوه بر این، نشان داده شده است که نکروز تومور که پس از شیمی درمانی قبل از عمل رخ میدهد، مهمترین متغیر پیش آگهی تعیین کننده بقا است. رژیم شیمیدرمانی بهینه برای استئوسارکوم هنوز مشخص نشده است، اما داروهایی که بیشتر مورد استفاده قرار میگیرند شامل دوکسوروبیسین و سیس پلاتین هستند؛ یک رژیم حاوی متوترکسات یک جایگزین معقول است. شیمیدرمانی چند دارویی نیز در سارکوم یوئینگ مؤثر نشان داده شده است. رژیمهای چند دارویی استاندارد شامل دوکسوروبیسین به همراه سیکلوفسفامید و ترکیبی از دوکسوروبیسین، وینکریستین و سیکلوفسفامید با یا بدون اکتینومایسین D (VDCA یا VDC) است.
پرتودرمانی
از آنجا که استئوسارکومها عموماً در برابر اشعه مقاوم هستند، پرتودرمانی عمدتاً برای تسکین تومورهای بزرگ و غیرقابل جراحی استفاده میشود. در مقابل، پرتودرمانی روش اصلی درمان برای اکثر سارکومهای یوئینگ موضعی است. پرتودرمانی قبل از عمل نیز ممکن است برای کاهش حجم تومور قبل از اقدام به برداشتن جراحی در نظر گرفته شود.
مدیریت بیماری عودکننده
تومورهای استخوانی از طریق جریان خون منتشر میشوند و معمولاً به ریهها و اسکلت استخوانی متاستاز میدهند. در گذشته، تنها 10 تا 30 درصد از بیمارانی که با استئوسارکوم متاستاتیک قابل تشخیص مراجعه میکردند، به بقای طولانی مدت دست مییافتند. مطالعات جدیدتر نشان دادهاند که رویکردهای ترکیبی شامل برداشتن جراحی تومور اولیه و رسوبات متاستاتیک همراه با شیمیدرمانی چند دارویی میتواند میزان بقای 5 ساله بدون بیماری را تا 47 درصد بهبود بخشد. سارکوم یوئینگ ممکن است تا 15 سال پس از تشخیص اولیه به شکل بیماری دوردست عود کند. در یک تجزیه و تحلیل گذشتهنگر از 241 بیمار مبتلا به سارکوم یوئینگ لگن، عوامل اصلی مؤثر بر پیشآگهی، حجم تومور، پاسخ به شیمیدرمانی و حاشیههای جراحی کافی بودند. بیمارانی که مشکوک به عود تومور هستند باید تحت ارزیابی کامل قرار گیرند تا میزان بیماری مشخص شود. برداشتن متاستازهای ریوی، اساس درمان بیماران مبتلا به استئوسارکوم است. پیشآگهی معمولاً با پاسخ به درمان قبلی، مدت زمان بهبودی و میزان متاستازها قابل تعیین است. درمان چندوجهی، شامل داروهای شیمیدرمانی که قبلاً استفاده نشدهاند، توصیه عمومی برای درمان است.
کوردومای ساکروکوکسیژیال
باقیمانده نوتوکورد محل منشأ تومور نادر کوردومای ساکروکوکسیژیال است. کوردوماها تومورهای تهاجمی موضعی هستند که تمایل زیادی به عود دارند. از آنجا که علائم میتوانند مبهم باشند، تشخیص میتواند به تأخیر بیفتد. برداشتن جراحی باید شامل یک تیم چند رشتهای باشد که شامل متخصص جراحی انکولوژی، جراح مغز و اعصاب و جراح پلاستیک ترمیمی است. یک روش دو مرحلهای اغلب در MDACC استفاده میشود. ابتدا، خونرسانی به تومور ناشی از عروق ایلیاک از طریق رویکرد قدامی کنترل میشود. چند روز بعد، تومور از طریق رویکرد خلفی برداشته میشود. پرتودرمانی باید به دلیل میزان بالای عود موضعی در نظر گرفته شود.

بدون دیدگاه