متخصصان جراحی انکولوژی اغلب توسط متخصصان زنان و زایمان عمومی برای کمک به مدیریت بیماران مبتلا به بدخیمیهای اولیه زنان مشاوره میشوند. بنابراین درک مراحل جراحی مربوط به هر فرآیند بیماری (یعنی تخمدان، لوله فالوپ، رحم، دهانه رحم، فرج و واژن) مهم است. این فصل اصول اساسی انکولوژی زنان را مورد بحث قرار میدهد تا در صورت مواجهه غیرمنتظره با این نئوپلاسمها، مدیریت مناسب انجام شود. تأکید بر تشخیص، مرحلهبندی و مدیریت جراحی است.
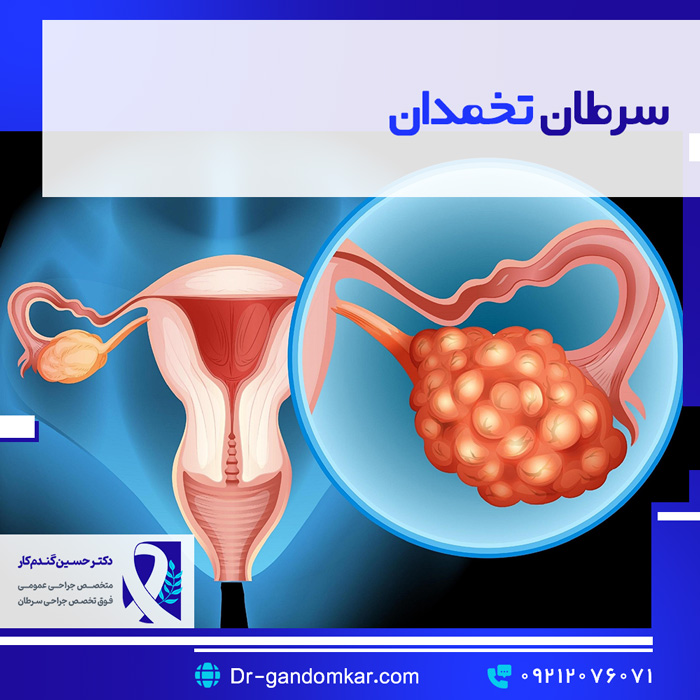
سرطان تخمدان
سرطان تخمدان بالاترین میزان مرگ و میر را در بین بدخیمیهای زنان دارد. هر ساله در ایالات متحده، تقریباً 22000 مورد جدید تشخیص داده میشود و 14000 زن بر اثر این بیماری جان خود را از دست میدهند. سرطانهای تخمدان ناهمگن هستند و زیرگروهها توسط بافتشناسی تعریف میشوند. شایعترین و “معمولترین” زیرگروه، سرطان اپیتلیال تخمدان است. سایر زیرگروههای کمتر شایع، تومورهای سلولهای زایا و تومورهای استرومایی طناب جنسی هستند.
سرطان تخمدان اپیتلیال
شیوع و عوامل خطر
سرطان تخمدان اپیتلیال در هر 70 زن در 1 نفر رخ میدهد و 90٪ از کل سرطانهای تخمدان را تشکیل میدهد. میانگین سن در زمان تشخیص 63 سال است. تقریباً 10٪ از این موارد ارثی هستند و به صورت اتوزومال غالب منتقل میشوند. سندرم سرطان تخمدان پستان ارثی (جهشهای BRCA-1 و BRCA-2) و سندرم لینچ/سرطان کولورکتال غیرپولیپوز ارثی (که در آن سرطانهای روده بزرگ، آندومتر، تخمدان و سایر سرطانها در بستگان درجه یک و دو تجمع مییابند) اشکال ارثی شناخته شده سرطان تخمدان هستند. تلاشهای اخیر در توالییابی نسل بعدی، جهشهای زایا دیگری را شناسایی کرده است که ممکن است نقشی داشته باشند و احتمالاً جهشهای ژنتیکی دیگری نیز هنوز شناسایی نشدهاند. عواملی که گمان میرود خطر ابتلا به سرطان تخمدان اپیتلیال را در زنان افزایش میدهند، عبارتند از افزایش سن (حداکثر سن ۷۰ سال)، عدم بارداری، شروع زودهنگام قاعدگی، یائسگی دیررس، تأخیر در فرزندآوری و تبار یهودیان اشکنازی. مطالعات اولیه حاکی از ارتباط با داروهای باروری (یعنی کلومیفن و گنادوتروپین) بود، اما مطالعات بعدی این ارتباط را تأیید نکردند. بستن لولههای رحمی و سالپنژکتومی، و همچنین استفاده از داروهای ضدبارداری خوراکی به مدت بیش از ۵ سال، اثر محافظتی در برابر ابتلا به سرطان تخمدان اپیتلیال نشان دادهاند.
آسیبشناسی
زیرگروههای تومور در جدول ۲۰.۱ فهرست شدهاند. مواردی از تومورهای مخاطی آپاندیس و تخمدان همزمان نیز گزارش شده است، اما از آنجا که گسترش سرطان آپاندیس به تخمدانها غیرمعمول نیست، تعیین محل واقعی بیماری اولیه میتواند دشوار باشد. همچنین نشان داده شده است که کارسینومهای تخمدان آندومتریوئید میزان بالاتری از کارسینومهای آندومتر همزمان دارند، اگرچه تعیین اینکه آیا تومورها تومورهای اولیه جداگانه هستند یا نشان دهنده بیماری متاستاتیک هستند، میتواند دشوار باشد.
| جدول20.1 توزیع درصد کارسینومهای اپیتلیال تخمدان بر اساس زیرگروه بافتشناسی |
 |
مسیرهای گسترش و محلهای متاستاز
از آنجا که سلولهای کنده شده تمایل دارند مسیر گردش خون مایع صفاقی را در پیش بگیرند و در این مسیر لانهگزینی کنند، رایجترین مسیر متاستاز، کاشت است. سرطان تخمدان اپیتلیال همچنین ممکن است به غدد لنفاوی متاستاز دهد. گسترش هماتوژن غیرمعمول است.
ویژگیهای بالینی
علائم. فاصله زمانی از شروع بیماری تا تشخیص اغلب به دلیل عدم وجود علائم خاص طولانی است. علائم غیر اختصاصی شامل مشکلات مداوم ادراری و شکمی است. تشخیص اغلب تا زمانی که بیماران به بیماری منتشر مبتلا نشوند، انجام نمیشود و بیش از 70٪ موارد در مرحله III یا IV مراجعه میکنند. بیماران مبتلا به بیماری مرحله IV و افیوژن پلور بدخیم ممکن است با سرفه یا تنگی نفس مراجعه کنند. تشخیص سرطان تخمدان با نتایج غیرطبیعی پاپ اسمیر (پاپ اسمیر) غیرمعمول است.
یافتههای فیزیکی. توده آدنکس مشاهده شده در معاینه معمول لگن و موج مایع قابل لمس اغلب در بیماران مبتلا به سرطان تخمدان اپیتلیال در مرحله پیشرفته یافت میشود. حدود ۵٪ از بیماران مبتلا به سرطان تخمدان احتمالی، تومور اولیه دیگری دارند که به تخمدان متاستاز داده است، اگرچه برخی تخمینها نشان میدهد که تا ۳۰٪ ممکن است متاستاز از سایر نقاط باشد. شایعترین سرطانهای اولیه که به تخمدان متاستاز میدهند، سرطانهای سینه، دستگاه گوارش و سایر سرطانهای زنان هستند.
بررسیهای قبل از درمان
معاینه فیزیکی دقیق، از جمله معاینه لگن با معاینه رکتوواژینال، مورد نیاز است. بررسیهای قبل از درمان همچنین شامل آزمایشهای بالینی (مانند شمارش کامل سلولهای خون، گلوکز سرم، نیتروژن اوره خون، کراتینین، عملکرد کبد، آلبومین سرم و CA-125 [که تقریباً در ۸۰٪ موارد بالا است])، رادیوگرافی قفسه سینه و ماموگرافی است. تجزیه و تحلیل توموگرافی کامپیوتری (CT) ممکن است به تعیین میزان بیماری کمک کند. کولونوسکوپی در بررسی روده بزرگ مفید است و میتواند به ویژه در تمایز بین سرطان اولیه تخمدان و سرطان اولیه روده بزرگ، که ممکن است به همان شکل بروز کنند، مفید باشد.
مرحلهبندی
طرح مرحلهبندی جراحی برای سرطان تخمدان اپیتلیال در جدول 20.2 آمده است.
درمان
به طور سنتی، گام اولیه در درمان، جراحی کاهش حجم تومور با روشهای مناسب مرحلهبندی حین عمل، از جمله تجزیه و تحلیل سیتولوژیک شکم و لگن (یا جمعآوری آسیت)، بررسی دقیق تمام ساختارها و سطوح شکم و لگن، هیسترکتومی کامل شکمی و سالپینگو-اووفورکتومی دو طرفه (به جز در مواردی که نگرانی در مورد باروری یا بیماری در مراحل اولیه وجود دارد)، برداشتن چادرینه و نمونهبرداری انتخابی از غدد لنفاوی لگن و پاراآئورت است. در بیماران مبتلا به تومور موسینوس یا آپاندیس درگیر، آپاندکتومی باید انجام شود. کاهش حجم تومور اولیه یک جزء کلیدی در موارد پیشرفته است زیرا بقا با میزان تومور باقیمانده رابطه معکوس دارد. در گذشته، جراحی کاهش حجم تومور بهینه به این صورت تعریف میشد که قطر بزرگترین ایمپلنت تومور باقیمانده کمتر از 1 سانتیمتر باشد. با این حال، اخیراً حرکتی برای بهروزرسانی تعریف جراحی کاهش تومور بهینه به عدم وجود بقایای بیماری قابل مشاهده صورت گرفته است، زیرا مطالعات نشان میدهد که نتایج در این جمعیت به طور قابل توجهی بهتر است.
| جدول20.2 مرحلهبندی جراحی سرطان تخمدان اپیتلیال یا سرطان لوله فالوپ |
 |
در موارد منتخب، ممکن است شیمیدرمانی نئوادجوانت (از ابتدا) و به دنبال آن یک روش کاهش حجم تومور (سیتوریداکشن) با فاصله زمانی، نقشی داشته باشد. در بیماران مبتلا به سرطان پیشرفته، شیمیدرمانی نئوادجوانت ممکن است برای افرادی که بیماریهای همراه متعددی دارند که مانع از جراحی تهاجمی برای کاهش حجم تومور میشود یا بیماری گستردهای که نمیتوان آن را به طور مطلوب کاهش داد (همانطور که توسط سیتیاسکن، لاپاراتومی یا لاپاروسکوپی تشخیصی مشخص میشود)، ضروری باشد.
اگرچه هنوز نتیجه قطعی حاصل نشده است، چندین کارآزمایی بزرگ و آیندهنگر، عدم برتری شیمیدرمانی نئوادجوانت را با کاهش حجم تومور در بیماران مبتلا به بیماری مرحله IIIC و IV نشان دادهاند. مطالعات در حال انجام است تا مشخص شود کدام بیماران، در صورت وجود، بیشترین سود را از شیمیدرمانی نئوادجوانت میبرند.
پس از کاهش حجم تومور با جراحی، بیماران باید با شیمیدرمانی ترکیبی مبتنی بر پلاتین و تاکسان درمان شوند. بواسیزوماب نیز ممکن است در این شرایط در نظر گرفته شود. افزودن بواسیزوماب با افزایش بقای بدون پیشرفت بیماری همراه بوده است، اگرچه هیچ افزایش بقای کلی در بیمارانی که به طور بهینه حجم تومورشان کاهش یافته است، نشان داده نشده است.
پس از شش تا هشت دوره شیمی درمانی، تصمیمات درمانی بر اساس وجود بیماری مداوم یا فاصله زمانی بدون بیماری گرفته میشود. پس از درمان، اکنون از مطالعات تصویربرداری برای تعیین پاسخ به درمان استفاده میشود. لاپاراتومی یا لاپاروسکوپی “نگاه دوم” دیگر به طور معمول استفاده نمیشود.
عوامل پیش آگهی
عوامل پاتولوژیک پیش آگهی شامل درجه تومور (درجه پایین یا بالا)، زیرگروه بافت شناسی و پلوئیدی DNA است. عوامل بالینی دارای اهمیت پیش آگهی شامل مرحله جراحی-پاتولوژیک، میزان بیماری باقیمانده پس از سیتورداکشن اولیه (جداول 20.3 و 20.4)، حجم آسیت، سن بیمار و وضعیت عملکرد بیمار است. بیمارانی که وضعیت عملکرد ضعیفی قبل از درمان دارند، بقای به طور قابل توجهی کوتاهتری نسبت به بیمارانی که وضعیت عملکرد خوبی دارند، دارند.
| جدول20.3 میزان بقای پنج ساله برای بیماران مبتلا به سرطان تخمدان اپیتلیال درجه بالا، بر اساس مرحله تومور و میزان بیماری باقی مانده |
 |
| جدول20.4نرخ بقای ده ساله و میانگین بقای سرطان تخمدان درجه پایین بر اساس مرحله تومور |
 |
نظارت توصیهشده
بیماران باید در دو سال اول هر ۳ تا ۴ ماه، در سالهای ۳ تا ۵ هر ۶ ماه و سپس سالانه پس از ۵ سال تحت نظر باشند. در هر ویزیت، معاینه فیزیکی با معاینه لگن باید انجام شود و گزینه پایش سطح CA-125 باید با بیمار در میان گذاشته شود. در صورت لزوم، میتوان سیتیاسکن قفسه سینه، شکم و لگن +/- یک جزء PET انجام داد.
تومورهای تخمدان با پتانسیل بدخیمی کم
شیوع و عوامل خطر
تومورهای تخمدان با پتانسیل بدخیمی کم (LMP) که گاهی اوقات به عنوان تومورهای مرزی شناخته میشوند، ۱۰ تا ۲۰ درصد از بدخیمیهای اپیتلیال تخمدان را تشکیل میدهند. بیشترین میزان بروز در بین زنان سفیدپوست است و میانگین سن در زمان تشخیص ۴۰ تا ۵۰ سال است (تقریباً ۱۰ تا ۲۰ سال جوانتر از سن ابتلا به سرطان اپیتلیال تخمدان). هیچ عامل خطری شناسایی نشده است و به نظر نمیرسد بارداری و هورمونهای برونزا محافظتکننده باشند. هیچ ارتباط آشکاری با سابقه خانوادگی وجود ندارد.
آسیبشناسی
شایعترین زیرگروههای بافتشناسی تومورهای تخمدانی LMP، سروزی و موسینوس هستند (جدول 20.5). تشخیص مستلزم عدم وجود تهاجم آشکار به استرومال است. ویژگیهای پاتولوژیک متمایز که ممکن است با سیر تهاجمیتر بیماری مرتبط باشند شامل معماری میکروپاپیلاری، تهاجم میکرو و ایمپلنتهای تهاجمی است.
ویژگیهای بالینی
بیماران مبتلا به تومورهای تخمدانی LMP، و همچنین مبتلایان به سرطانهای تخمدانی اپیتلیال، علائم مشابهی دارند. شایعترین علائم درد یا ناراحتی در قسمت تحتانی شکم، سیری زودرس، سوء هاضمه و احساس بزرگ شدن شکم است. تومورهای تخمدانی LMP همچنین میتوانند به عنوان یک توده آدنکس در معاینه معمول لگن شناسایی شوند. سطح CA-125 ممکن است در تومورهای سروزی افزایش یابد.
درمان
برخلاف بیماران مبتلا به سرطان تخمدان اپیتلیال تهاجمی، اکثریت قریب به اتفاق بیماران مبتلا به تومورهای تخمدانی مرزی در مراحل اولیه بیماری تشخیص داده میشوند. درمان توصیه شده برای همه بیماران جراحی اولیه است. در بیمارانی که در مرحله اول بیماری هستند و تمایل به بچهدار شدن در آینده دارند، باید روشهای حفظ باروری انجام شود. هیچ فایده اثباتشدهای برای درمان کمکی در درمان این سرطان، حتی در بیماران مبتلا به بیماری در مرحله پیشرفته، وجود ندارد. معمولاً این تومورها سیر بالینی کندی دارند و ممکن است پس از یک دوره طولانی بدون بیماری، عود کنند. مرحله تومور مهمترین پیشبینیکننده بقا است (جدول 20.6). کاهش ثانویه سیتوردکشن را میتوان در بیماران منتخب با بیماری عودکننده در نظر گرفت.
| جدول 20.5 توزیع تومورهای تخمدان با پتانسیل بدخیمی پایین، بر اساس مرحله تومور و نوع بافتشناسی |
 |
| جدول20.6میزان بقای پنج ساله برای بیماران مبتلا به تومورهای تخمدان با پتانسیل بدخیمی کم، بر اساس مرحله تومور |
 |
تومورهای سلول زایا تخمدان
شیوع و عوامل خطر
تومورهای سلول زایا دومین نوع شایع تومور تخمدان هستند. در بین زنان 20 سال یا کمتر، تا 75٪ تومورهای تخمدان منشأ سلول زایا دارند و تا یک سوم آنها بدخیم هستند. میانگین سن در زمان تشخیص 19 سال است. تومورهای سلول زایا به ندرت پس از دهه سوم زندگی رخ میدهند. شصت تا 75٪ موارد در زمان تشخیص در مرحله I هستند.
پاتولوژی
زیرگروههای بافتشناسی تومورهای سلول زایا و میزان بروز آنها در جدول 20.7 فهرست شده است.
| جدول20.7 ویژگیهای بالینی تومورهای سلولهای زایای تخمدان، بر اساس زیرگروه بافتشناسی |
 |
مسیرهای انتشار و محلهای متاستاز
تومورهای سلول زایا همان پتانسیل تومورهای اپیتلیال تخمدان را برای متاستاز دارند.
ویژگیهای بالینی
بدخیمیهای سلول زایا به سرعت رشد میکنند و اغلب با درد ثانویه به پیچخوردگی، خونریزی یا نکروز مشخص میشوند. آنها همچنین ممکن است باعث ایجاد اثرات تودهای از جمله شکایات مثانه یا رکتوم یا ناهنجاریهای قاعدگی شوند. دیسژرمینومها تا 20 تا 30 درصد از تومورهای بدخیم تخمدان را که در دوران بارداری تشخیص داده میشوند، تشکیل میدهند. کارسینومهای جنینی ممکن است استروژن تولید کنند و باعث بلوغ زودرس شوند.
بررسیهای قبل از درمان
معاینه فیزیکی دقیق، از جمله معاینه لگن، مورد نیاز است. سایر اجزای بررسیهای قبل از درمان شامل آزمایشهای بالینی (مانند شمارش کامل سلولهای خون، گلوکز سرم، نیتروژن اوره خون، کراتینین، عملکرد کبد، آلبومین سرم) و رادیوگرافی قفسه سینه است. نشانگرهای سرم، از جمله آلفا-فتوپروتئین، بتا-گنادوتروپین جفتی انسانی (β-hCG) و لاکتیک دهیدروژناز، باید اندازهگیری شوند (جدول 20.7). زنان قبل از قاعدگی با توده تخمدانی باید تحت آزمایش کاریوتایپ قرار گیرند زیرا میزان بروز گنادهای دیسژنیک در بیماران مبتلا به این تومورها افزایش مییابد.
مرحلهبندی
معیارهای مرحلهبندی جراحی همان معیارهای سرطان اپیتلیال تخمدان است (جدول 20.2).
درمان
به طور کلی، مرحلهبندی جراحی شامل سالپنگواوفورکتومی یک طرفه (در صورت تمایل به حفظ باروری)، سیتولوژی صفاقی، چادرینهبرداری و بیوپسیهای انتخابی از غدد لنفاوی خلف صفاق و ساختارهای شکمی است. برای بیمارانی که بیماری آنها به طور ناکافی مرحلهبندی شده است، دو گزینه وجود دارد: بررسی مجدد جراحی و مرحلهبندی مناسب، و شروع شیمیدرمانی بدون بررسی مجدد. در بیشتر موارد، به تعویق انداختن شیمیدرمانی با بررسی مجدد و مرحلهبندی ضروری نیست زیرا این تومورها به شدت به شیمیدرمانی حساس هستند.
شیمیدرمانی برای همه بیماران مبتلا به تومورهای سلول زایا توصیه میشود، اگرچه شیمیدرمانی برای افراد مبتلا به تومورهای مرحله I همچنان بحثبرانگیز است. شیمیدرمانی باید 7 تا 10 روز پس از بررسی جراحی به دلیل رشد سریع تومور آغاز شود. رژیم درمانی خط اول، بلئومایسین، اتوپوزید و سیس پلاتین است که به مدت سه یا چهار دوره با فواصل 21 روزه تجویز میشود. رادیوتراپی ممکن است نقش محدودی در درمان دیسژرمینومها داشته باشد.
عوامل پیشآگهی
میزان بقا برای زیرگروههای تومور سلول زایا تخمدان در جدول 20.8 فهرست شده است. عوامل پیشآگهی برای تراتومهای نابالغ شامل درجه تومور، وسعت بیماری در زمان تشخیص و میزان تومور باقیمانده است. درجه تومور تراتومهای نابالغ با میزان بافت نابالغ موجود تعیین میشود. سن بالاتر با افزایش خطر عود در دیسژرمینومها مرتبط بوده است. مرحله تومور نیز یک عامل پیشآگهی مهم برای همه تومورهای سلولهای زایای تخمدان است (جدول 20.9).
نظارت توصیهشده
بیماران باید هر 3 تا 4 ماه برای 2 سال اول و سپس سالانه پیگیری شوند. در هر ویزیت باید معاینه فیزیکی با معاینه لگن انجام شود. در صورت بالا بودن اولیه آزمایشها (مانند CA-125، α-فتوپروتئین، β-hCG و لاکتیک دهیدروژناز) باید بررسی شوند. در صورت لزوم بالینی، میتوان سیتیاسکن قفسه سینه، شکم و لگن +/- اسکن PET/CT انجام داد.
| جدول20.8 میزان بقای پنج ساله برای بیماران مبتلا به شایعترین تومورهای سلولهای زایای تخمدان، بر اساس زیرگروه بافتشناسی و مرحله تومور |
 |
تومورهای استرومایی طناب جنسی
شیوع و عوامل خطر
تومورهای استرومایی طناب جنسی ۵ تا ۸ درصد از بدخیمیهای تخمدان و تا ۵ درصد از بدخیمیهای دوران کودکی را تشکیل میدهند. وقوع قبل از شروع قاعدگی اغلب با بلوغ زودرس همراه است.
آسیبشناسی
همانطور که از نامشان پیداست، این تومورها از طنابهای جنسی یا استروما مشتق میشوند. مشتقات آنها شامل سلولهای گرانولوزا، سلولهای تکا، سلولهای استرومایی، سلولهای سرتولی، سلولهای لیدیگ و سلولهایی شبیه به پیشسازهای جنینی این انواع سلولها هستند.
مسیرهای انتشار و محلهای متاستاز
الگو و محلهای گسترش متاستاتیک مشابه سرطانهای اپیتلیال تخمدان است.
ویژگیهای بالینی
فیبرومها و فیبروسارکومها. فیبرومها و فیبروسارکومها شایعترین تومورهای استرومایی طناب جنسی هستند و ۴ درصد از نئوپلاسمهای تخمدان را تشکیل میدهند. میانگین سن تشخیص فیبرومها در دهه پنجم زندگی است. ده درصد از این ضایعات دو طرفه هستند. علائم شامل آسیت به ویژه در بیمارانی با تومورهایی با قطر بیش از 6 سانتی متر، افزایش قطر شکم، سندرم میگز (افیوژن پلور راست و آسیت) و سندرم گورلین با خالهای پایه است. این تومورها در درجه اول بیاثر هستند اما ممکن است مقادیر کمی استروژن ترشح کنند.
تومورهای سلول گرانولوزا. تومورهای سلول گرانولوزا 1٪ تا 2٪ از تومورهای تخمدان را تشکیل میدهند. تومورهای نوع بزرگسال (90٪ تا 95٪ از تومورهای سلول گرانولوزا) با ترشح استروژن اضافی مشخص میشوند. بیماران ممکن است بینظمی قاعدگی یا خونریزی پس از یائسگی را تجربه کنند. پنج تا 15٪ از بیماران با شکم حاد ناشی از خونریزی تومور مراجعه میکنند.
بیماران مبتلا به تومورهای سلول گرانولوزا از نوع نوجوانان (5٪ تا 10٪ از تومورهای سلول گرانولوزا) همچنین میتوانند با خونریزی غیرطبیعی رحم و درد شکم مراجعه کنند. از آنجا که تومورهای سلول گرانولوزا استروژن تولید میکنند، فرآیندهای پاتولوژیک آندومتر همزمان در تقریباً 30٪ از بیماران رخ میدهد. در موارد نادر، این تومورها ممکن است تستوسترون تولید کرده و برخی ویژگیهای مردانهسازی را ایجاد کنند.
| جدول20.9 میزان بقای پنج ساله برای بیماران مبتلا به تومورهای سلول زایا تخمدان، بر اساس مرحله تومور |
 |
تکوماها. تکوماها نادرتر از تومورهای سلول گرانولوزا هستند، اما استروژن نیز تولید میکنند. میانگین سن در زمان تشخیص حدود ۵۰ سال است و این تومورها به ندرت دو طرفه هستند. اختلالات قاعدگی و خونریزی پس از یائسگی شایعترین علائم ظاهری هستند.
تومورهای سلول سرتولی. میانگین سن در زمان تشخیص تومورهای سلول سرتولی تقریباً ۳۰ سال است، اما این تومورها میتوانند در هر سنی رخ دهند. تومورهای سلول سرتولی یک طرفه هستند. بیماران بیشتر علائمی مربوط به استروژن اضافی دارند، اگرچه ممکن است علائم مردانهسازی را نشان دهند. به ندرت، هیپرآلدوسترونمی به صورت فشار خون بالا و هیپرکالمی ممکن است ایجاد شود. هفتاد درصد از این تومورها هم استروژن و هم آندروژن تولید میکنند، در حالی که ۲۰٪ فقط آندروژن تولید میکنند.
تومورهای سلول لیدیگ. تومورهای سلول لیدیگ در میانگین سنی ۵۰ تا ۷۰ سال رخ میدهند اما میتوانند در هر سنی رخ دهند. این تومورها اغلب یک طرفه هستند. علائم اغلب شامل نشانههای مردانهسازی یا خونریزی پس از یائسگی است که به دلیل تمایل به تولید آندروژنها و/یا استروژن ایجاد میشود.
تومورهای سلول سرتولی-لیدیگ. تومورهای سلول سرتولی-لیدیگ میتوانند در هر سنی رخ دهند، اما 75٪ آنها قبل از 40 سالگی رخ میدهند. این تومورها به ندرت دو طرفه هستند. بیشتر این تومورها تستوسترون تولید میکنند و مردانهسازی ممکن است در 85٪ از بیماران رخ دهد.
ژیناندروبلاستوما. ژیناندروبلاستوماها تومورهای نادری با میانگین سن تشخیص 30 سال هستند. از نظر بافتشناسی، هم اجزای سلول گرانولوزا و هم اجزای سلول سرتولی-لیدیگ ممکن است در این تومورها وجود داشته باشند. بیماران ممکن است اثرات استروژنی یا مردانهسازی ثانویه به محصولات هورمونی این تومورها را تجربه کنند. این تومورها ممکن است آندروژن یا استروژن تولید کنند یا ممکن است بیاثر باشند.
تومورهای طناب جنسی با لولههای حلقوی. میانگین سنی بیماران مبتلا به تومورهای طناب جنسی با لولههای حلقوی ۲۵ تا ۳۵ سال است. این تومورها ممکن است با سندرم پوتز-جگرز مرتبط باشند و در این موارد، ۶۶٪ دو طرفه هستند و بیشتر آنها استروژن تولید میکنند. این تومورها همچنین با آدنوکارسینومهای اندوسرویکس مرتبط هستند.
بررسیهای قبل از درمان
معاینه فیزیکی دقیق، از جمله معاینه لگن، مورد نیاز است. سایر اجزای بررسیهای قبل از درمان شامل آزمایشهای بالینی (مانند شمارش کامل سلولهای خون، گلوکز سرم، نیتروژن اوره خون، کراتینین، عملکرد کبد، آلبومین سرم، CA-125)، رادیوگرافی قفسه سینه و ماموگرافی است. ارزیابی غلظت سرمی استرادیول، دهیدرواپیآندروسترون، تستوسترون، ۱۷-OH-پروژسترون و هیدروکورتیزون ممکن است در تشخیص مفید باشد. سیتیاسکن و سونوگرافی باید برای ارزیابی غدد فوق کلیوی و تخمدانها انجام شود. اگرچه مطالعات تصویربرداری ممکن است مفید باشند، اما اغلب روش مرحلهبندی برنامهریزی شده را تغییر نمیدهند.
مرحلهبندی
معیارهای مرحلهبندی جراحی مشابه معیارهای سرطان اپیتلیال تخمدان است (جدول 20.2).
درمان
به طور کلی، مرحلهبندی جراحی تومورهای استرومایی طناب جنسی میتواند با سالپنگواوفورکتومی یک طرفه (در صورت تمایل به حفظ باروری)، سیتولوژی صفاقی، امنتکتومی اینفراکولیک، بیوپسیهای انتخابی از غدد و ساختارهای شکمی و بیوپسیهای هدفمند مناسب انجام شود. اگر هیسترکتومی در زمان جراحی انجام نشود، باید اتساع و کورتاژ و کورتاژ اندوسرویکس برای ارزیابی هرگونه فرآیند پاتولوژیک همزمان انجام شود.
| جدول20.10 میزان بقای پنج ساله برای بیماران مبتلا به تومورهای استرومایی طناب نخاعی، بر اساس زیرگروه بافتشناسی |
 |
تومورهای با منشأ استرومایی (یعنی تکوماها و فیبروماها) و تومورهای سلول لیدیگ عموماً سیر خوشخیمی دارند؛ جراحی تنها درمان است.
تومورهای سلول سرتولی یا سلول گرانولوزا عموماً از نوع LMP هستند، تمایل به عود دارند و به ندرت متاستاز میدهند. درمان کمکی پس از عمل با بلئومایسین، اتوپوزید و سیس پلاتین یا سایر شیمیدرمانیهای مبتنی بر پلاتین باید در بیمارانی که بیماری آنها از مرحله I بیشتر است یا تومورهای عودکننده دارند، یا تومورهای مرحله I با خطر بالاتر مانند تومورهایی که عناصر هترولوگ دارند یا تمایز ضعیفی دارند، در نظر گرفته شود. پرتودرمانی لگن نیز میتواند در درمان این بیماران نقش داشته باشد.
عوامل پیشآگهی
سن پایینتر و مراحل پایینتر با نتایج بقای بهتر مرتبط هستند. میزان بقا در جداول 20.10 و 20.11 شرح داده شده است.
نظارت توصیهشده
بیماران باید در دو سال اول هر ۳ تا ۴ ماه و سپس هر ۶ ماه پیگیری شوند. معاینه فیزیکی با معاینه لگن باید در هر ویزیت انجام شود. توصیههای فعلی نشان میدهد که دادههای کافی برای پشتیبانی از استفاده معمول از نشانگرهای تومور سرم وجود ندارد، اما برخی از پزشکان در صورت بالا بودن اولیه آنها در هر ویزیت، نتایج آزمایشها را بررسی میکنند. طبق دستورالعمل بالینی، میتوان سیتیاسکن قفسه سینه، شکم و لگن، +/- یک جزء PET انجام داد.
مدیریت سرطانهای تصادفی یافتشده در لاپاراتومی
یافتن یک توده تخمدانی ناشناخته در زمان لاپاراتومی اکتشافی یا در لاپاراتومی برای یک بیماری نامرتبط میتواند یک معضل درمانی برای جراح ایجاد کند. درمان مناسب به عوامل مختلفی از جمله سن بیمار، اندازه و قوام توده، احتمال دو طرفه بودن و درگیری آشکار سایر ساختارها بستگی دارد. رضایت آگاهانه یک جزء کلیدی در تصمیمگیری است. مگر در مواردی که وضعیت تهدیدکننده زندگی وجود داشته باشد، هیسترکتومی و سالپنگواوفورکتومی دو طرفه باید فقط با رضایت آگاهانه مناسب انجام شود، به خصوص در زنان در سن باروری.
| جدول20.11 نرخ بقای پنج ساله برای همه بیماران مبتلا به تومورهای استرومایی طناب نخاعی |
 |
توده تخمدان در زنان قبل از یائسگی: کیستهای عملکردی
یک توده ناشناخته در یک بیمار جوان به احتمال زیاد خوشخیم است. شایعترین تودههای خوشخیم یافت شده در آدنکسها، کیستهای عملکردی هستند که مربوط به فرآیند تخمکگذاری میباشند. این کیستها قابل توجه هستند زیرا نمیتوان آنها را به راحتی از نئوپلاسمهای واقعی تنها بر اساس دلایل بالینی تشخیص داد. جسم زرد که در طول تخمکگذاری تشکیل میشود، در صورت وجود خونریزی در داخل آن، ممکن است به طور غیرطبیعی بزرگ شود.
بیماری که جسم زرد خونریزی دهنده دارد، ممکن است با شکم حاد مراجعه کند که نیاز به جراحی دارد. اغلب میتوان ناحیه خونریزی را بدون نیاز به برداشتن کیست، لوله فالوپ یا تخمدان، بخیه زد. رفع کیستهای ساده تا 5 سانتیمتر که به طور تصادفی یافت میشوند را میتوان با معاینه فیزیکی به تنهایی یا همراه با سونوگرافی لگن ارزیابی کرد.
سایر تودههای شایع. سایر تودههای شایع تخمدان که در زنان قبل از یائسگی یافت میشوند در جدول 20.12 فهرست شدهاند. تودهها ممکن است بدون علامت باشند، اما اگر به اندازه کافی بزرگ باشند، ممکن است باعث درد شکم یا لگن شوند.
پیچ خوردگی تخمدان ممکن است با تودههای تخمدانی رخ دهد و معمولاً در کودکان، زنان جوان و زنان باردار رخ میدهد. درد حاد شدید شکم معمولاً علامت اولیه است و این وضعیت یک اورژانس جراحی محسوب میشود. اگر بیمار از نظر همودینامیک پایدار باشد، باید لاپاراسکوپی تشخیصی در نظر گرفته شود.
| جدول20.12 تودههای خوشخیم تخمدان در زنان قبل از یائسگی |
 |
درمان
اگر هنگام باز کردن شکم، آسیت وجود داشته باشد، باید تخلیه شده و برای تجزیه و تحلیل سیتولوژیک ارسال شود. پس از بررسی و لمس دقیق، اگر توده تخمدانی به نظر محدود به یک تخمدان باشد و به بدخیمی مشکوک باشیم، در بیشتر موارد سالپنگواوفورکتومی یک طرفه مناسب است. اگر توده خوش خیم تلقی شود، سیستکتومی تخمدان ممکن است ترجیح داده شود. کپسول تخمدان باید از نظر هرگونه شواهدی از پارگی، چسبندگی یا زائده بررسی شود. پس از برداشتن، نمونه تخمدان باید برای معاینه برش منجمد ارسال شود. در صورت تشخیص بدخیمی، مرحله بندی جراحی باید انجام شود. این شامل بیوپسی از چادرینه، سطوح صفاقی لگن و قسمت فوقانی شکم و غدد لنفاوی خلف صفاق (شامل هر دو ناحیه پاراآئورت و لگن دو طرفه) است.
اگر تخمدان مقابل طبیعی به نظر برسد، بیوپسی تصادفی یا برداشتن گوه ای اندیکاسیون ندارد زیرا ممکن است به دلیل چسبندگی صفاقی یا نارسایی تخمدان در باروری آینده اختلال ایجاد کند. اگر تشخیص بافتشناسی بر اساس نتایج برش منجمد مشکوک باشد، همیشه ترجیح داده میشود که قبل از اقدام به هیسترکتومی و سالپنگواوفورکتومی دو طرفه در یک بیمار جوان، منتظر نتایج برش دائمی باشید. معیارهای کلی برای مدیریت محافظهکارانه شامل بیماران جوانی است که مایل به فرزندآوری در آینده هستند؛ رضایت بیمار و خانواده و توافق برای پیگیری دقیق؛ عدم وجود شواهدی از غدد جنسی دیسژنتیک؛ هرگونه تومور بدخیم یک طرفه سلول زایا، استرومایی یا مرزی؛ و تومور اپیتلیال تهاجمی مرحله IA.
پیشرفتها در تولید مثل کمکی تأثیر زیادی بر تصمیمات مدیریت حین عمل داشته است. به طور سنتی، اگر سالپنگواوفورکتومی دو طرفه لازم باشد، هیسترکتومی نیز انجام شده است.
با این حال، فناوری فعلی برای انتقال تخمک اهدایی و پشتیبانی هورمونی، به زنی که تخمدان ندارد اجازه میدهد تا بارداری داخل رحمی طبیعی داشته باشد. به طور مشابه، اگر رحم و یک لوله و تخمدان به دلیل درگیری تومور برداشته شوند، تکنیکهای فعلی امکان بازیابی تخمکها از تخمدان باقیمانده بیمار، لقاح آزمایشگاهی با اسپرم همسر او و کاشت جنین در رحم جایگزین را فراهم میکنند.
توده تخمدان در زنان یائسه. خطر بدخیم بودن توده تخمدان از ۴۰ سالگی شروع به افزایش میکند و پس از آن به طور پیوسته افزایش مییابد. بنابراین، یافتن توده تخمدانی ناشناخته در یک زن یائسه شومتر است. شایعترین نئوپلاسمهای بدخیم در این گروه سنی، تومورهای اپیتلیال بدخیم هستند. تومورهای سلولهای زایا و سلولهای استرومایی به ندرت رخ میدهند. ضایعات خوشخیم، مانند سیستآدنوماهای اپیتلیال و کیستهای درموئید، هنوز هم میتوانند در این جمعیت رخ دهند، اگرچه بسیار کمتر از بیماران جوانتر رخ میدهند. درمان توده تخمدانی غیرمنتظره در یک بیمار یائسه شامل سالپنگواوفورکتومی و مرحلهبندی بیشتر در صورتی است که برش منجمد تشخیص سرطان را نشان دهد. همچنین باید بیوپسیهای مرحلهبندی مناسب انجام شود. باید با یک متخصص انکولوژی زنان مشورت شود.
لاپاراسکوپی برای مدیریت سرطان تخمدان
لاپاراسکوپی به عنوان رویکرد جراحی استاندارد برای تودههای خوشخیم و مشکوک آدنکس به طور گسترده مورد استفاده قرار گرفته است. نقش لاپاراسکوپی در درمان سرطان تخمدان کمتر مشخص است، اما برخی مطالعات نشان دادهاند که میتوان آن را با خیال راحت در زمان مرحلهبندی جراحی برای بیماران مبتلا به سرطان تخمدان در مراحل اولیه استفاده کرد. نقش لاپاراسکوپی در درمان بیماران مبتلا به سرطان تخمدان پیشرفته هنوز نیاز به تعریف دارد، اگرچه جراحی لاپاراسکوپی با عوارض بسیار کمتری نسبت به لاپاراتومی همراه است.


بدون دیدگاه