سرطان با محل اولیه ناشناخته (CUP) یک گروه ناهمگن از سرطانها است که ۳ تا ۴ درصد از تشخیصهای جدید سرطان را تشکیل میدهد و میتواند یک چالش درمانی ایجاد کند. اگرچه شیمیدرمانی روش درمانی اصلی در بیماران مبتلا به CUP است، اما جراح ممکن است نقش مهمی در تشخیص و درمان این بیماران داشته باشد. به طور خاص، اغلب از جراحان خواسته میشود بیمارانی را که سرطانهایی با متاستازهای منفرد (غدد لنفاوی یا کبد به عنوان تظاهرات رایج) یا کارسینوماتوز دارند، ارزیابی کنند.
در این فصل، ما در مورد تظاهرات و ویژگیهای بالینی CUP بحث میکنیم؛ یک رویکرد عملی برای ارزیابی تشخیصی بیماران مبتلا به CUP – از جمله نقش پروفایل مولکولی بافت مبدا و توالییابی نسل بعدی (NGS) در عصر ایمونوهیستوشیمی پیچیده – را شرح میدهیم؛ نقش جراحی را در سناریوهای مختلف بالینی مورد بحث قرار میدهیم؛ و به طور خلاصه گزینههای درمانی شیمیدرمانی و ایمونوتراپی جدید را بررسی میکنیم.
تعریف و ملاحظات کلی
CUP با وجود یک سرطان اثبات شده با بیوپسی تعریف میشود که منشأ آناتومیکی تومور اولیه پس از شرح حال کامل و معاینه فیزیکی مشخص نمیشود. فرضیه غالب در CUP این است که تومور اولیه یا میکروسکوپی باقی میماند و از تشخیص بالینی فرار میکند یا پس از ایجاد متاستاز ناپدید میشود، که ممکن است به دلیل بیکفایتی رگزایی تومور اولیه باشد.
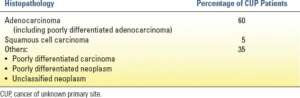
این تومورها اغلب بر اساس زیرگروه بافتشناسی، از جمله سرطان سلول سنگفرشی، آدنوکارسینوم (از جمله آدنوکارسینوم با تمایز ضعیف)، کارسینوم با تمایز ضعیف یا تمایز نیافته، یا نئوپلاسمهای تمایز نیافته (نامی که به گروه ناهمگنی از تومورهای با منشأ سلولی مختلف داده میشود) گروهبندی میشوند. جدول 22.1 فراوانی هر زیرگروه را فهرست میکند (آدنوکارسینوم شایعترین است).
همانطور که در یک مجموعه بزرگ یافت میشود، شایعترین مکانهای متاستاز CUP غدد لنفاوی، استخوانها، ریهها، کبد و صفاق هستند. سایر محلهای متاستاتیک شامل مغز، مننژ، پلور، بافتهای زیر جلدی، غدد فوق کلیوی و کلیهها هستند. در بیشتر بیماران، محل منشأ بیماری متاستاتیک هرگز تشخیص داده نمیشود. در تعداد کمی، یک تومور اولیه نهفته در نهایت در طول عمر بیمار از طریق معاینات بالینی، جراحی یا کالبدشکافی شناسایی میشود. مطالعات قدیمیتر گزارش میدهند که محل اولیه تنها در 25٪ موارد CUP در طول عمر بیمار شناسایی میشود. این تعداد با تکنیکهای تصویربرداری پیشرفته (که مطالعات پایه منفی بودهاند) کمتر است. متاستازهای ناشی از سرطانهای سلول سنگفرشی معمولاً از ناحیه سر و گردن یا ریهها منشأ میگیرند، در حالی که آدنوکارسینومهای متاستاتیک از ریهها، سینهها، غده تیروئید، پانکراس، کبد، معده، روده بزرگ یا رکتوم منشأ میگیرند.
همانطور که در شکل 22.1 نشان داده شده است، یک بیمار میتواند با CUP واقعی (بدون سرطان اولیه که در ارزیابی متمرکز اما کامل یافت میشود) یا گاهی اوقات با تشخیص نهایی نامشخص (سرطان جدید در مقابل عود در بیماری با سابقه سرطان قبلاً درمان شده) به کلینیک CUP مراجعه کند. علاوه بر این، با توجه به تصویربرداری غیر اختصاصی و یافتههای پاتولوژیک، مراجعه بیماران مبتلا به کلانژیوکارسینومای متاستاتیک در کلینیک CUP غیرمعمول نیست، اگرچه پزشکان به طور فزایندهای قادر به تمایز بین این دو هستند، با معیارهای تصویربرداری بهتر و الگوهای شناخته شده گسترش (ریهها، استخوان و چادرینه).
| جدول 22.1 زیرگروههای هیستوپاتولوژیک CUP |
 |
میانگین بقای بیماران مبتلا به CUP 6 تا 9 ماه است. زیرگروههای خاصی از بیماران مبتلا به CUP متاستاتیک، مانند کسانی که میتوانند با درمان مناسب درمان شوند، پیشآگهی به طور قابل توجهی بهتری نسبت به کل گروه دارند. این گروه مطلوب شامل بیماران مبتلا به سرطان سلول سنگفرشی متاستاتیک به غدد لنفاوی گردن، زنان مبتلا به آدنوکارسینوم متاستاتیک در غدد لنفاوی زیر بغل، مردان مبتلا به سرطان تمایز نیافته و سطح بالای β-hCG یا α-fetoprotein (AFP)، زنان مبتلا به کارسینوماتوز صفاقی و بیماران مبتلا به CUP نورواندوکرین است. این زیرگروهها بعداً در این فصل با جزئیات بیشتری مورد بحث قرار میگیرند.
هدف درمانی در ارزیابی بیماران مبتلا به CUP شناسایی بیمارانی است که درمان قطعی یا درمان خاص مؤثر برای آنها یک گزینه است. علاوه بر این، گزینههای درمانی موضعی میتوانند به طور بالقوه به کنترل و تسکین کافی بیماری در بیماران منتخب کمک کنند.
شرح حال و معاینه فیزیکی
در بیماران مبتلا به CUP، شرح حال کامل و معاینه فیزیکی ضروری است. سابقه بدخیمی فردی یا سابقه خانوادگی سرطان ممکن است پزشک را در تعیین محل تومور اولیه مخفی راهنمایی کند. در طول معاینه فیزیکی بیمار مبتلا به CUP، چندین محل آناتومیک توجه ویژهای را میطلبد. سر و گردن باید به طور کامل معاینه شوند، به ویژه هنگامی که تشخیص سرطان سلول سنگفرشی داده شده باشد. این شامل معاینه اوروفارنکس، هیپوفارنکس، نازوفارنکس و حنجره است که معمولاً با لارنگوسکوپی غیرمستقیم یا فیبراپتیک انجام میشود. غده تیروئید باید از نظر بزرگی یا عدم تقارن بررسی شود. تمام حوزههای غدد لنفاوی، از جمله حوزههای سر و گردن و نواحی فوق ترقوه، زیر بغل و کشاله ران، باید از نظر غدد لنفاوی قابل لمس یا بزرگ شده بررسی شوند.
در زنان، معاینه دقیق پستان و معاینه کامل لگن دو دستی باید انجام شود. برای مردان، معاینه بیضه و پروستات از اهمیت ویژهای برخوردار است. همه بیماران باید تحت معاینه کامل پوست و معاینه رکتوم قرار گیرند.
مطالعات آزمایشگاهی
آزمایشهای روتین مانند شمارش کامل سلولهای خون، مطالعات شیمیایی و آزمایشهای عملکرد کبد باید در همه بیماران انجام شود و در صورت کمخونی یا علامتدار بودن بیمار، مدفوع باید از نظر خون مخفی بررسی شود. فراتر از این آزمایشهای اولیه، آزمایشگاه بالینی در ارزیابی تشخیصی بیماران مبتلا به CUP کاربرد محدودی دارد، اما بر اساس یافتههای بافتشناسی و رادیولوژیکی باید مطالعات بیشتری درخواست شود. نشانگرهای تومور سرم، اگرچه برای تشخیص کافی نیستند، اما در پیگیری پیشرفت درمان بیمار مفید هستند. میکروسکوپ الکترونی میتواند وقتگیر و گران باشد؛ بنابراین، با در دسترس بودن رنگهای ایمونوهیستوشیمی، میکروسکوپ الکترونی به ندرت مورد استفاده قرار میگیرد.
آنالیز ایمونوهیستوشیمی
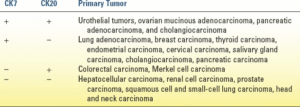
آنالیزهای ایمونوهیستوشیمی به یک روش معمول برای میکروسکوپ نوری تبدیل شدهاند و طیف گستردهای از نشانگرهای ایمونوهیستوشیمی برای کمک به تشخیص پس از میکروسکوپ نوری استفاده میشوند. نشانگرهای رایج مورد استفاده برای آدنوکارسینومها شامل فاکتور رونویسی تیروئید (TTF-1) و سیتوکراتینهای (CK) 7 و 20 هستند. TTF-1، یک پروتئین هستهای، میتواند در سرطانهای ریه و تیروئید مثبت باشد. حدود 65 تا 70 درصد از آدنوکارسینومهای ریه و 25 درصد از سرطانهای ریه سلول سنگفرشی برای TTF-1 مثبت هستند و در بیماران مبتلا به CUP، این آزمایش در تمایز بین تومور اولیه ریه و آدنوکارسینوم متاستاتیک (به عنوان مثال، در بیمارانی که با افیوژن پلور متاستاتیک مراجعه میکنند) مفید است. الگوی ترکیبی نشانگر CK که در جدول 22.2 نشان داده شده است نیز مفید است. نشانگرهای پستان شامل گیرنده استروژن (ER)، گیرنده پروژسترون (PR)، Her-2/neu و پروتئین فیبروز بیماری کیستیک ناخالص باید در زنانی که با آدنوکارسینوم، به ویژه آدنوپاتی زیر بغل ایزوله مراجعه میکنند، بررسی شوند. Hep-par-1، یک نشانگر کارسینوم هپاتوسلولار، به تشخیص سرطان هپاتوسلولار کمک میکند و CK-19 گاهی اوقات برای کلانژیوکارسینوما استفاده میشود. تشخیص کلانژیوکارسینومای متاستاتیک، آدنوکارسینوم متاستاتیک و کارسینوم هپاتوسلولار در بیمارانی که با بیماری متاستاتیک فقط کبدی مراجعه میکنند، میتواند دشوار باشد. سایر نشانگرهایی که به صورت هدفمند بر اساس نتایج میکروسکوپی گذشته استفاده میشوند عبارتند از: اسید فسفاتاز پروستات و PSA برای سرطان پروستات و انولاز اختصاصی نورون و کروموگرانین برای سرطانهای نورواندوکرین. تومورهای سلولهای زایا اغلب برای β-hCG و AFP رنگآمیزی میشوند.
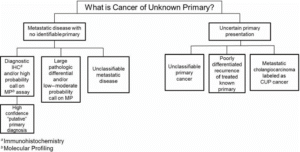 |
| شکل ۲۲.۱ چالشهای تشخیصی برای شناسایی بافت منشأ – به CUP کمک میکند. |
ارزیابی رادیوگرافی
ارزیابیهای رادیوگرافی بیماران مبتلا به CUP باید بر شناسایی تومور اولیه و تعیین وسعت بیماری متاستاتیک متمرکز باشد.
سیتیاسکن قفسه سینه، شکم و لگن
در صورت عدم منع مصرف به دلیل اختلال عملکرد کلیه یا حساسیت به ماده حاجب، سیتیاسکن قفسه سینه، شکم و لگن با ماده حاجب داخل وریدی مبتنی بر ید برای بررسی وضعیت بیمار CUP ضروری است، زیرا میتواند به تعیین محل تومور اولیه، ارزیابی وسعت بیماری و انتخاب در دسترسترین محل بیوپسی کمک کند.
ماموگرافی
زنان مبتلا به آدنوکارسینوم و در سن باروری یا بالاتر، به ویژه زنانی که آدنوکارسینوم متاستاتیک دارند، باید ظرف یک سال تحت ماموگرافی قرار گیرند. متأسفانه، شناسایی ناهنجاریهای رادیوگرافی ظریف در زنان جوانتر که اغلب بافت سینه بسیار متراکمی دارند، دشوار است. اگر یافتههای ماموگرافی و سونوگرافی سینه منفی باشد، تصویربرداری رزونانس مغناطیسی (MRI) سینه در زنانی که با آدنوپاتی زیر بغل منفرد مراجعه میکنند، توصیه میشود.
تصویربرداری تشدید مغناطیسی
در صورتی که سیتیاسکن با ماده حاجب داخل وریدی منع مصرف داشته باشد، ممکن است امآرآی تجویز شود. همانطور که قبلاً ذکر شد، مشخصترین نقش امآرآی در سرطان پستان اولیه (CUP) در زنانی است که با متاستاز غدد لنفاوی زیر بغل و مشکوک به سرطان پستان اولیه مخفی مراجعه میکنند. نتایج چندین مطالعه نشان میدهد که امآرآی پستان میتواند به تشخیص تومور در حداکثر 75٪ از بیماران کمک کند. این نتیجه میتواند بر مدیریت جراحی تأثیر بگذارد، به طوری که امآرآی منفی پستان، بازده پایین در ماستکتومی را پیشبینی میکند.
توموگرافی انتشار پوزیترون
نقش اسکن توموگرافی انتشار پوزیترون (PET) با استفاده از 18F-fluoro-2-deoxy-D-glucose (18F-FDG PET) برای ارزیابی اولیه “همه بیماران” مبتلا به سرطانهای CUP بحثبرانگیز است. تصویربرداری PET در بیماران مبتلا به سرطان اولیه مخفی سر و گردن که با کارسینوم سلول سنگفرشی (CUP دهانه رحم) مراجعه میکنند و در بیماران منتخبی که با یک ضایعه منفرد CUP که به طور بالقوه قابل برداشتن است، مراجعه میکنند، توصیه میشود. چندین مطالعه کوچک اخیر، نقش PET را در بیمارانی که با CUP گردنی مراجعه میکنند، توصیف کردهاند.
مزایای تعیین محل تومور اولیه در بیمارانی که با لنفادنوپاتی گردنی (سرطان مخفی سر و گردن) مراجعه میکنند، پورتهای تابشی کوچکتر پس از عمل است که میتواند عوارض زودرس و دیررس را کاهش دهد، نظارت بهتر برای عود و تعیین پیشآگهی بهتر را بهبود بخشد. بررسی 16 مطالعه (1994 تا 2003) از 302 بیمار مبتلا به متاستاز غدد لنفاوی گردنی از تومورهای اولیه ناشناخته توسط Rusthoven و همکارانش نشان داد که PET میتواند در تشخیص تومورهای اولیه ناشناخته و/یا متاستازهای منطقهای یا دوردست که قبلاً تشخیص داده نشدهاند، در مقایسه با بررسیهای مرسوم، از جمله پانآندوسکوپی، سیتیاسکن یا MRI، کمک کند.
حساسیت، ویژگی و دقت PET برای تشخیص تومورهای اولیه ناشناخته در بیماران مبتلا به متاستاز غدد لنفاوی گردنی به ترتیب 88.3٪، 74.9٪ و 78.8٪ بود. FDG-PET در مقایسه با روشهای معمول تشخیصی، ۲۵٪ تومورهای اولیه و ۲۷٪ متاستازهای منطقهای یا دوردست بیشتری را در این بیماران شناسایی کرد.
به طور کلی، جستجوی جامع محل تومور اولیه در این بیماران با ارزیابی رادیوگرافی میتواند برای بیماران گران، ناخوشایند و اضطرابآور باشد و اغلب تأثیر قابل توجهی بر درمان بیماران یا سیر نهایی بیماری آنها ندارد. با این حال، PET یک روش مفید در بیماران CUP است که عمدتاً بیماری استخوانی دارند، زیرا برخلاف اسکن استخوان یا سیتیاسکن، میتوان از آن برای نظارت بر پاسخ به درمان استفاده کرد.
ارزیابی پاتولوژیک
بیوپسی آسپیراسیون با سوزن ظریف (FNA) تا حد زیادی جایگزین بیوپسی هسته به عنوان اولین آزمایش پاتولوژیک شده است. پس از آن میتوان بیوپسی هسته، بیوپسی برشی یا بیوپسی برشی را در صورت نیاز برای شناسایی بافتشناسی دقیقتر انجام داد. ارتباط خوب بین پزشک و پاتولوژیست مهم است، زیرا جزئیات شرح حال و معاینه فیزیکی میتواند بر بررسی پاتولوژیک تأثیر بگذارد و در صورت لزوم، ارسال بافت اضافی را برای تشخیص دقیق تسهیل کند.
میکروسکوپ نوری
میکروسکوپ نوری (رنگآمیزی هماتوکسیلین و ائوزین) معمولاً برای تعیین سلول منشأ کافی است. حدود 60٪ از CUP در میکروسکوپ نوری آدنوکارسینوم تشخیص داده میشوند. 5٪ دیگر کارسینوم سلول سنگفرشی هستند و 35٪ باقی مانده به عنوان آدنوکارسینوم با تمایز ضعیف، کارسینوم با تمایز ضعیف یا نئوپلاسم با تمایز ضعیف تشخیص داده میشوند. میکروسکوپ الکترونی، که به شناسایی ویژگیهای فوق ساختاری سلول منشأ کمک میکند، به ندرت مورد نیاز است. به عنوان مثال، دسموزومها و پلهای درون سلولی با سرطان سلول سنگفرشی مرتبط هستند، در حالی که اتصالات محکم، میکروویلیها و فضاهای آسینار با آدنوکارسینوم مرتبط هستند. پیش ملانوزومها با ملانوما مرتبط هستند و گرانولهای عصبی-ترشحی با تومورهای سلول کوچک یا نورواندوکرین مرتبط هستند. لنفوم معمولاً با عدم وجود اتصالات بین سلولها در میکروسکوپ الکترونی مشخص میشود.
| جدول 22.2 رویکردی به نشانگرهای ایمونوهیستوشیمی مورد استفاده در سرطان با محل اولیه ناشناخته |
 |
| جدول 22.3 نقش بالینی نشانگر ایمونوهیستوشیمی منتخب |
 |
هیچ نشانگر ایمونوهیستوشیمی به تنهایی ۱۰۰٪ اختصاصی نیست و بسیاری از این آزمایشها (و همچنین نشانگرهای سرمی) میتوانند گیجکننده و ناهماهنگ با رادیولوژی باشند و به ندرت در جستجوی تومور اولیه یا در برنامهریزی درمان کمک میکنند. اگرچه، وقتی به صورت گروهی استفاده میشوند، الگوهای خاصی از نشانگرهای IHC حساسیت و اختصاصیت تشخیص را در زمینه سلولی مناسب افزایش میدهند (به عنوان مثال، CDX-2 (+)، CK20 (+) و CK7 (-) به شدت نشاندهنده پروفایل سرطان کولورکتال در بیماری هستند که با کارسینوماتوز مراجعه میکند). در حال حاضر، سیتوژنتیک به ندرت در تشخیص CUP استفاده میشود.
نشانگرهای تومور سرم
متاسفانه، بیماران مبتلا به CUP معمولاً بیان بیش از حد غیر اختصاصی بسیاری از نشانگرهای تومور سرمی، از جمله β-hCG، AFP، CEA، CA 125، CA 19-9 و CA 15-3 را دارند. در بیمارانی که با کارسینوم تمایز نیافته یا کارسینوم تمایز نیافته ضعیف (به ویژه با تومور خط میانی) مراجعه میکنند، باید β-hCG و AFP برای رد سرطانهای پنهان رده زایا آزمایش شوند. هیچ یک از این نشانگرها ویژگی یا حساسیت کافی برای شناسایی مداوم تومور اولیه و همچنین ارزش پیشبینیکننده برای پاسخ به شیمیدرمانی یا بقا ندارند. جدول22.3 چندین نشانگر تومور رایج و نقش آنها را در ارزیابی بالینی بیماران مبتلا به CUP فهرست میکند.
نقش بافت منشأ سنجشهای پروفایل مولکولی
تشخیص دقیق محل اولیه در CUP بر پیشآگهی و مدیریت بیماران تأثیر میگذارد و امکان انتخاب درمانهای هدفمند برای بدخیمیها از بافت منشأ را فراهم میکند. پروفایل مولکولی تومورها امکان طبقهبندی سیستماتیک سرطان انسان را فراهم میکند و روشی برای بهبود تشخیص محل منشأ احتمالی در بیماران CUP است. آزمایشهای مولکولی که امضاهای مولکولی بافت منشأ را شناسایی میکنند، برای طبقهبندی سرطانهای CUP به صورت تجاری در دسترس هستند. مطالعات متعددی امکان استفاده از پروفایل بیان ژن با آنالیز ریزآرایه DNA را برای طبقهبندی تومورهای نامشخص بر اساس بافت منشأ آنها، با شناسایی زیرمجموعههای ژنی که بیان آنها هر کلاس سرطانی را مشخص میکند، نشان دادهاند. این مطالعات در شناسایی بافت منشأ در 78 تا 89 درصد تومورها به دقت دست یافتهاند.
علاوه بر این، نشان داده شده است که الگوهای بیان ژن با بافت منشأ سازگار باقی میمانند و در متاستازهای دوردست نیز حفظ میشوند، حتی اگر متاستازها پس از یک بازه طولانی ایجاد شوند. بنابراین، از نظر تئوری میتوان یک پایگاه داده جامع بیان ژن ایجاد کرد که اکثر انواع تومور را در بر میگیرد و از آن به عنوان یک ابزار تشخیصی بالینی استفاده کرد.
پلتفرمهای ریزآرایه DNA و سنجشهای PCR کمی رونویسی معکوس (qRT-PCR) از RNA پیامرسان (mRNA) استخراج شده از بافت تومور تازه منجمد یا تثبیت شده در فرمالین که در پارافین جاسازی شده (FFPE) خالصسازی، تکثیر و با رنگهای فلورسنت برچسبگذاری شده است، استفاده میکنند. متعاقباً، با یک ریزآرایه DNA متشکل از صدها یا هزاران کاوشگر اختصاصی ژن که مکمل توالیهای ژنی متعدد هستند، هیبرید میشود. سطوح نسبی بیان ژن در نمونهها با اندازهگیری شدت فلورسانس برای هر کاوشگر تخمین زده میشود. این نوع استراتژی میتواند برای مدیریت CUP با مقایسه الگوی بیان چند ژنی یک CUP و انتساب نمونه CUP به نوع تومور اولیه، که امضای مولکولی CUP بیشترین شباهت را به آن دارد، مورد استفاده قرار گیرد. در کلینیک، واکنش زنجیرهای پلیمراز کمی بلادرنگ (RT-PCR) “استاندارد طلایی” برای تجزیه و تحلیل بیان ژن است. با این حال، RT-PCR ظرفیت بسیار کمتری در اندازهگیری، حداکثر چند صد ژن از بافتهای FFPE دارد و ممکن است کیفیت پایینتری نسبت به بافت منجمد داشته باشد. تثبیت فرمالین میتواند باعث تشکیل پیوندهای متقاطع بین پروتئینها یا بین پروتئینها و اسیدهای نوکلئیک شود که در مقایسه با بافتهای منجمد باعث خلوص پایینتر RNA میشود.
چندین مطالعه گذشتهنگر و آیندهنگر، نقش سنجشهای موجود در بازار را در شرایط CUP ارزیابی کردهاند. مطالعه آیندهنگر توسط هینزورث و همکارانش، 289 بیمار CUP را ارزیابی کرد. از این تعداد، 252 نفر سنجشهای موفقیتآمیزی انجام دادند و 247 نفر (98٪) بافت منشأ پیشبینیشده داشتند. محلهایی که معمولاً پیشبینی میشدند، صفراوی (18٪)، اوروتلیال (11٪)، کولورکتال (10٪) و ریه غیرسلول کوچک (7٪) بودند. از 194 بیماری که درمان موضعی دریافت کردند، میانگین زمان بقا 12.5 ماه بود (95٪ CI، 9.1 تا 15.4 ماه). استفاده معمول از ابزار پروفایل بیان ژن در تشخیص و مدیریت سرطان اولیه ناشناخته هنوز محدودیتهایی دارد. از آنجایی که سرطان اولیه در دسترس نیست، دقت آزمایش را نمیتوان به راحتی تعیین کرد. علاوه بر این، ممکن است تفاوتهای ژنومی بین سرطان CUP و تومور اولیه جامد شناخته شده مشابه وجود داشته باشد که نتایج درمانی متفاوتی را به همراه دارد. این احتمالات، سوالاتی را در مورد تأثیر بالینی تعیین بافت منشأ و انجام تجزیه و تحلیل جهشی بیماری متاستاتیک در CUP ایجاد میکند.
در حال حاضر، اگرچه آزمایش پروفایل بیان ژن مبتنی بر ریزآرایه، نیاز به بررسی بالینی کامل را برطرف نمیکند، اما ممکن است در بیماران منتخب، آزمایش متمرکزتر را تسهیل کند، به خصوص در افرادی که کارسینومهای تمایز نیافته با پروفایلهای ایمونوهیستوشیمی غیر اختصاصی دارند. آزمایشهای آیندهنگر، بهویژه در عصر NGS، ضروری هستند.
پروفایلینگ جهشی: نقش توالییابی نسل بعدی در CUP
همانند سرطانهای شناختهشده، فایده NGS برای همه افراد مبتلا به CUP در حال حاضر به خوبی تعریف نشده است. راس و همکارانش دادههایی را در مورد 125 آدنوکارسینوم CUP و 75 CUP بدون ویژگیهای آدنوکارسینوم ارائه کردند. آنها نتیجه گرفتند که حداقل یک تغییر ژنومی (GA) در 192 (96٪) نمونه CUP، با میانگین (انحراف معیار) 4.2 (2.8) GA در هر تومور، یافت شد. پنج جهش شایع گزارششده در TP53 (110 [55٪])، KRAS (40 [20٪])، CDKN2A (37 [19٪])، MYC (23 [12٪]) و ARID1A (21 [11٪]) بودند. بحث فعلی این است که آیا زمینه سلولی و طبقهبندی بافت در صورت شناسایی جهشهای قابل پیگیری اهمیت دارند یا خیر. حقیقت ممکن است جایی در این بین باشد و به محل بیماری و دادههای کلی کلینیکوپاتولوژیک بستگی دارد. مطالعات آیندهنگر بیشتری برای تعیین تأثیر بالینی NGS در سرطانهای CUP (یعنی تأثیر بر برنامهریزی درمان، بقا و کیفیت زندگی) ضروری است.
مکانهای خاص بیماری
سرطان متاستاتیک به غدد لنفاوی گردن
غدد لنفاوی بزرگ شده گردن اغلب در بیوپسی برای سرطان متاستاتیک مثبت تشخیص داده میشوند. بیماران مبتلا به سرطان سلول سنگفرشی متاستاتیک به غدد لنفاوی گردن و محل تومور اولیه ناشناخته، پیشآگهی بهتری نسبت به بیماران مبتلا به CUP به طور کلی دارند.
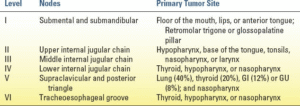
گردن شامل بیش از 25 حوضه گرهی است. این گرهها برای استانداردسازی ارزیابی پاتولوژیک بیماران به شش دسته خاص گروهبندی شدهاند. طبقهبندی غدد لنفاوی گردن در جدول 22.4 نشان داده شده است. شایعترین محل متاستاز در بیماران مبتلا به سرطان سلول سنگفرشی سر و گردن، غدد لنفاوی ژوگولودیگاستریک یا سطح II زنجیره ژوگولار داخلی فوقانی و پس از آن غدد لنفاوی میان ژوگولار یا سطح III است.
متاستاز به سایر گروههای غدد لنفاوی گردن با فراوانی کمتری رخ میدهد. در بیمارانی که غدد لنفاوی گردن آنها ناشی از تومور اولیه سلول سنگفرشی مخفی است، معاینه دقیق سر و گردن ضروری است. برای مشاهده کل اوروفارنکس، هیپوفارنکس، نازوفارنکس و حنجره باید از نور و آینه کافی استفاده شود. سیتیاسکن سر و گردن (اغلب شامل سیتیاسکن قفسه سینه) برای تعیین محل تومور اولیه و به دست آوردن اطلاعات کامل مرحلهبندی توصیه میشود. همانطور که قبلاً در متن ذکر شد، برخی از این بیماران کاندید اسکن PET/CT نیز هستند.
اگر در معاینه فیزیکی و تصویربرداری PET/PET-CT هیچ تومور اولیهای یافت نشود، پانآندوسکوپی گام بعدی رایج است. این کار معمولاً در اتاق عمل با بیمار تحت بیهوشی عمومی انجام میشود. ازوفاگوسکوپی، لارنگوسکوپی، برونکوسکوپی و نازوفارنگواسکوپی به منظور تجسم ناحیه و به دست آوردن نمونههای بیوپسی از شایعترین محلهای سرطان سلول سنگفرشی مخفی در ناحیه سر و گردن انجام میشوند. بیوپسیهای تصادفی از محتملترین محلهای تومور بر اساس محل آدنوپاتی انجام میشوند. محلهای معمول تومور اولیه مخفی در سرطان سلول سنگفرشی عبارتند از نازوفارنکس، قاعده میانی زبان، سینوس پیریفورم و لوزهها. جدول 22.4 الگوی رایج متاستاز گردن رحم از تومورهای مختلف سلول سنگفرشی در ناحیه سر و گردن را نشان میدهد. بر اساس محل متاستازهای غدد لنفاوی، برونیابی منبع احتمالی تومور اولیه مخفی اغلب امکانپذیر است و معاینه آندوسکوپی باید بر روی این مکانها متمرکز شود. لوزهبرداری دو طرفه بخش مهمی از فرآیند مرحلهبندی و ارزیابی است، زیرا دیدن یک سرطان اولیه کوچک پنهان در حفرههای عمیق لوزهها نادر نیست.
| جدول22.4 طبقهبندی غدد لنفاوی گردنی و محلهای احتمالی تومورهای اولیه مربوطه |
 |
اگر محل تومور اولیه در آندوسکوپی قابل شناسایی نباشد، رویکرد استاندارد ترکیبی از تشریح رادیکال گردن و پرتودرمانی پس از عمل است. نقش شیمیدرمانی به وجود غدد لنفاوی حجیم (بیماری N3) بستگی دارد و شیمیدرمانی نئوادجوانت به خوبی مطالعه نشده است. بر اساس سریهای بزرگ، میزان بقای 5 ساله مورد انتظار در این بیماران 32 تا 55 درصد و میزان کلی کنترل موضعی 75 تا 85 درصد است. بیمارانی که گسترش خارج گرهای یا غدد لنفاوی > 6 سانتیمتر (بیماری N3) دارند، میزان عود موضعی و متاستاز دوردست بالاتری دارند.
بیماران مبتلا به آدنوکارسینوم متاستاتیک در غدد لنفاوی گردنی ناشی از تومور اولیه مخفی، نتیجه نامطلوبتری نسبت به بیماران مبتلا به سرطان سلول سنگفرشی دارند. سریهای گذشتهنگر نشان دادهاند که لنفادنکتومی و پرتودرمانی در آدنوکارسینوم بسیار کمتر از کارسینوم سلول سنگفرشی مؤثر هستند. میزان عود موضعی در این موارد تقریباً ۱۰۰٪ و میزان بقای ۵ ساله ۰٪ تا ۱۰٪ است.
مورد توجه ویژه، وجود یک غده لنفاوی بزرگ شده ویرشو (سوپراکلاویکولار) است که در بیماران مبتلا به آدنوکارسینوم متاستاتیک شایع است. یک مطالعه به صورت گذشتهنگر ۱۵۲ نمونه بیوپسی FNA از غدد لنفاوی سوپراکلاویکولار را بررسی کرد و محل تومور اولیه را در زمانی که متاستاز در سمت راست و سمت چپ بود، مقایسه کرد. شانزده مورد از ۱۹ تومور اولیه لگن به غده لنفاوی سوپراکلاویکولار چپ متاستاز دادند و همه (۶ مورد از ۶ مورد) بدخیمیهای اولیه شکم به غده لنفاوی سوپراکلاویکولار چپ متاستاز دادند. با این حال، بدخیمیهای قفسه سینه، پستان و سر و گردن از نظر الگوهای متاستاز به غدد لنفاوی سوپراکلاویکولار راست و چپ تفاوتی نداشتند. بر اساس این اطلاعات، جستجوی تومور اولیه باید در بیمارانی که با آدنوکارسینوم در گره ویرچو سمت چپ مراجعه میکنند، بر روی شکم و لگن متمرکز شود. شیمیدرمانی خط مقدم بر اساس تظاهرات بالینی-پاتولوژیک اغلب درمان انتخابی در این بیماران است، به خصوص با توجه به نگرانی در مورد زیستشناسی تهاجمی. در بیماران مبتلا به آدنوکارسینوم دهانه رحم و بیماری منفرد یا کند، گزینههای موضعی-منطقهای از جمله جراحی یا پرتودرمانی را میتوان پس از یک دوره شیمیدرمانی در نظر گرفت، اگرچه هیچ کارآزمایی آیندهنگر وجود ندارد.
سرطان متاستاتیک ایزوله شده به غدد لنفاوی زیر بغل
مطالعه بافتشناسی تومور باید برای هدایت ارزیابی بیماران مبتلا به سرطان متاستاتیک به غدد لنفاوی زیر بغل استفاده شود. بیماران مبتلا به سرطان سلول سنگفرشی متاستاتیک به غدد لنفاوی زیر بغل باید تحت معاینه دقیق پوست؛ معاینه کامل سر و گردن؛ و سیتیاسکن سر، گردن و قفسه سینه قرار گیرند تا به دنبال تومور اولیه سلول سنگفرشی مخفی باشند. مردان مبتلا به آدنوکارسینوم متاستاتیک به غدد لنفاوی زیر بغل و CUP باید از نظر تومورهای اولیه ریه، دستگاه گوارش و دستگاه ادراری تناسلی ارزیابی شوند. زنان مبتلا به آدنوکارسینوم متاستاتیک به غدد لنفاوی زیر بغل نیز باید به طور مشابه ارزیابی شوند، اگرچه در زنان نگرانی برای تومور اولیه مخفی پستان زیاد است. زنان مبتلا به سرطان سینه مخفی که با متاستازهای زیر بغل مراجعه میکنند، تقریباً 0.32٪ از کل زنان مبتلا به سرطان پستان را تشکیل میدهند. هنگامی که بسیاری از این بیماران برای تشخیص احتمالی سرطان پستان تحت درمان قرار میگیرند، نتایج عود و بقا مشابه بیمارانی با مرحله مشابه سرطان پستان و تومور اولیه شناخته شده است.
بررسی گذشتهنگر نمونههای ماستکتومی از بیماران مبتلا به تومورهای اولیه مخفی نشان داد که در 50 تا 65 درصد موارد، تومور اولیه در نهایت در نمونه جراحی شناسایی شد. هر زن باید ماموگرافی و به دنبال آن سونوگرافی پستان انجام دهد اگر ماموگرافی منفی باشد (به ویژه در بیماران جوانتر با سینههای متراکم). همانطور که قبلاً بحث شد، MRI پستان در زنانی که با آدنوپاتی زیر بغل و CUP مراجعه میکنند، زمانی که یافتههای ماموگرافی و سونوگرافی منفی باشد، نشان داده میشود.
نمونه بیوپسی از غدد لنفاوی باید تحت ارزیابی بافتشناسی و ایمونوهیستوشیمی معمول برای ER، PR و Her-2/neu قرار گیرد. علاوه بر این، سایر نشانگرهای پستان از جمله GATA-3 و ماموگلوبین نیز انجام میشوند. اگرچه نه حساسیت بالایی دارند و نه اختصاصیت بالایی، وجود ER یا PR در این سناریوی بالینی به شدت نشان دهنده تومور اولیه پستان است.
درمان زنان مبتلا به آدنوکارسینوم متاستاتیک به غدد لنفاوی زیر بغل در طول دهه گذشته به طور چشمگیری تکامل یافته است. سه رویکرد کلی عبارتند از ماستکتومی فوری، مشاهده و پرتودرمانی. در صورت منفی بودن مطالعات تصویربرداری، ماستکتومی فوری در اکثر بیماران انجام نمیشود زیرا احتمال یافتن اولیه کم است. مشاهده با تشریح زیر بغل میتواند منجر به عود در پستان (25 تا 75 درصد، بسته به مطالعه) شود که نیاز به درمان بیشتر دارد. رویکرد سوم، درمان حفظ پستان با پرتودرمانی موضعی-منطقهای است که نشان داده شده است میزان عود موضعی را کاهش میدهد و رویکرد ترجیحی برای اکثر بیماران در مرکز سرطان MD Anderson است.
نتایج ما نشان میدهد که در بیمارانی که فقط تحت عمل جراحی برداشتن غدد لنفاوی زیر بغل قرار گرفتهاند، میزان عود موضعی در 10 سال 65٪ است، در حالی که ترکیبی از برداشتن غدد لنفاوی زیر بغل و پرتودرمانی، میزان عود موضعی را به 25٪ کاهش میدهد. با این درمان، میزان بقای کلی تفاوتی با بیمارانی که در همان مرحله غدد لنفاوی بیماری قرار دارند و تحت عمل جراحی ماستکتومی قرار گرفتهاند، نداشت.
افزودن شیمیدرمانی کمکی به جراحی و پرتودرمانی، میزان بقا را در 10 سال از 60٪ به 85٪ افزایش داد. تاموکسیفن باید بخشی از درمان برای زنانی در هر سنی باشد که تومور اولیه (در صورت شناسایی) یا متاستاز غدد لنفاوی زیر بغل آنها، گیرنده استروژن یا پروژسترون را بیان میکند.
یک مطالعه گذشتهنگر در مرکز سرطان MD Anderson شامل 45 زن با متاستاز غدد لنفاوی زیر بغل ایزوله بدون تومور اولیه شناخته شده بود. میانگین مدت پیگیری 7 سال بود. بیماران تحت ماستکتومی یا درمان حفظ پستان قرار گرفتند. در 71٪ از بیماران از پرتودرمانی خارجی و در 73٪ از شیمیدرمانی سیستمیک استفاده شد. هیچ تفاوت معنیداری بین ماستکتومی و حفظ پستان در عود موضعی-منطقهای، متاستازهای دوردست یا میزان بقای 5 ساله مشاهده نشد. صرف نظر از درمان جراحی مورد استفاده، تعداد غدد لنفاوی درگیر تنها عامل تعیینکننده بقا بود.
سرطان متاستاتیک به غدد لنفاوی کشاله ران از یک محل اولیه ناشناخته
یک مورد نسبتاً نادر از متاستاز CUP، متاستاز به غدد لنفاوی کشاله ران است. به استثنای ملانوما، دو نوع بافتشناسی شایع، کارسینوم طبقهبندی نشده و کارسینوم سلول سنگفرشی هستند.
آدنوکارسینوم به ندرت مشاهده میشود. در ارزیابی بیماران مبتلا به متاستاز کشاله ران، بررسی کامل تومور اولیه باید شامل معاینه پوست اندام تحتانی، پرینه، باسن، کانال مقعد و ناحیه لگن باشد. اگر غدد لنفاوی کشاله ران تنها ناحیه تظاهر بیماری باشد، برداشتن و به دنبال آن پرتودرمانی موضعی گام ترجیحی بعدی است. برای آدنوپاتی دو طرفه حجیم، شیمیدرمانی نئوادجوانت و به دنبال آن جراحی (برش غدد لنفاوی کشاله ران) و پرتودرمانی نیز میتوانند در نظر گرفته شوند، اگر هیچ محل دیگری از بیماری متاستاتیک وجود نداشته باشد. این بیماران پس از درمان چندوجهی مستعد ابتلا به لنف ادم هستند، بنابراین باید در مورد خطرات آن آموزش ببینند و در صورت بروز لنف ادم، تحت درمان قرار گیرند.
کارسینوماتوز صفاقی با محل اولیه ناشناخته
بیماران مبتلا به کارسینوماتوز صفاقی با محل اولیه ناشناخته میتوانند با آسیت، انسداد روده یا علائم گوارشی غیر اختصاصی مراجعه کنند. دو زیرگروه در این دسته شامل (الف) بیماران مبتلا به آدنوکارسینوم تولیدکننده موسین با و بدون سلولهای حلقهای و (ب) زنان مبتلا به کارسینوماتوز صفاقی اولیه هستند. بیماران مبتلا به آدنوکارسینوم تولیدکننده موسین اغلب دارای چندین ایمپلنت صفاقی هستند که محل اولیه آنها به احتمال زیاد دستگاه گوارش (یعنی معده، روده کوچک، آپاندیس یا روده بزرگ) است. بیماران این گروه پیشآگهی ضعیفتری دارند و به رژیمهای درمانی موجود فعلی پاسخ ضعیفی میدهند.
این بیماران باید برای ارزیابی تومور اولیه دستگاه گوارش، تحت آندوسکوپی فوقانی و کولونوسکوپی قرار گیرند. اگر آنالیز ایمونوهیستوشیمی الگوی CK 20+، CK7−، CDX2+ را نشان دهد – یک پروفایل بالقوه سرطان روده بزرگ – یک رژیم درمانی مبتنی بر سرطان روده بزرگ اغلب حتی در غیاب تومور اولیه روده بزرگ در نظر گرفته میشود.
زیرگروه دوم شامل زنانی با کارسینوماتوز اولیه صفاقی است. آنالیز هیستوپاتولوژیک این بیماران، سلولهایی با ویژگیهای پاپیلاری سروز و گاهی اوقات اجسام پساموما را نشان میدهد. این بیماران ممکن است سطح CA 125 بالایی داشته باشند اما سرطان تخمدان آشکاری ندارند (نتایج منفی در سیتیاسکن لگن و سونوگرافی ترانس واژینال).
مطالعات متعددی نشان دادهاند که زنانی که با کارسینوماتوز صفاقی مراجعه میکنند باید به روشی مشابه با افراد مبتلا به سرطان تخمدان پیشرفته شناخته شده، از جمله حداکثر کاهش حجم تومور با جراحی در لاپاراتومی اولیه و به دنبال آن شیمیدرمانی ترکیبی مبتنی بر پلاتین، درمان شوند. یک مطالعه نشان داد که میانگین بقای طولانی مدت ۱۳ ماه در بیمارانی که تحت شیمی درمانی مبتنی بر پاکلیتاکسل و کربوپلاتین قرار گرفته بودند، مشاهده شد و ۲۵٪ از بیماران بقای بدون پیشرفت بیش از ۲ سال داشتند.
تومور اولیه ناشناخته با بیماری متاستاتیک کبد
جراح گاهی اوقات در ارزیابی بیمارانی که با بیماری متاستاتیک به کبد از یک تومور اولیه ناشناخته مراجعه میکنند، مشارکت دارد. تومور کبد ممکن است زمانی کشف شود که بیمار در معاینه فیزیکی معمول یا به طور تصادفی در یک مطالعه رادیولوژیک مانند سونوگرافی شکم یا سی تی اسکن علائمی را نشان دهد. هنگامی که بیماران با بیماری متاستاتیک به کبد و CUP مراجعه میکنند، شایعترین نوع سلول، آدنوکارسینوما (تقریباً ۶۰٪ تا ۶۵٪) است. با این حال، کارسینوم آناپلاستیک یا با تمایز ضعیف، کارسینوم سلول کوچک، کارسینوم سلول سنگفرشی، سرطان نورواندوکرین و تومورهای طبقهبندی نشده نیز یافت میشوند.
بیشتر بیماران تحت سیتیاسکن قفسه سینه، شکم و لگن؛ ماموگرافی (در زنان)؛ و در صورت لزوم با توجه به دادهها یا علائم، آندوسکوپی فوقانی و کولونوسکوپی قرار میگیرند.
بقای کلی این بیماران معمولاً ضعیف است (میانگین، ۷ ماه)، اگرچه میتوان در بیمارانی که وضعیت عملکردی خوبی دارند و به شیمیدرمانی پاسخ میدهند، افزایش بقا (تقریباً ۱۲ ماه) را مشاهده کرد. لازم به ذکر است که میزان بروز کلانژیوکارسینوما در ۵ سال گذشته افزایش یافته است، که تا حدی به دلیل شناسایی بهتر این سرطانها است که قبلاً به عنوان CUP شناخته میشدند.
زیرگروهی از بیمارانی که با CUP و متاستازهای کبدی مراجعه میکنند، کارسینوم نورواندوکرین درجه پایین دارند. این موارد ممکن است به طور تصادفی یا زمانی که بیماران از علائم هورمونی (اسهال، گرگرفتگی یا حالت تهوع) یا درد شکایت دارند، تشخیص داده شوند. سرطانهای نورواندوکرین درجه پایین میتوانند برای چندین سال با پیشرفت آهسته باقی بمانند و ممکن است برای مدت طولانی نیازی به درمان (هورمونی یا سایر موارد) نداشته باشند. نشانگرهای تومور، از جمله کروموگرانین سرم، انولاز اختصاصی نورون و ۵-HIAA ادرار، ممکن است افزایش یافته باشند. اگر بیماری علائم کارسینوئید داشته باشد، باید از درمان غدد درون ریز به تنهایی برای علائم مرتبط با هورمون با آنالوگهای سوماتوستاتین استفاده شود.
درمانهای موضعی خاص، مانند هپاتکتومی راست یا کموآمبولیزاسیون، یا درمانهای سیستمیک، مانند شیمیدرمانی یا درمان هدفمند اخیراً توسعهیافته (عوامل ضد رگزایی و مهارکنندههای mTOR) در موارد زیر توصیه میشوند: (1) اگر بیمار بیماری حجیم یا پیشرفت بیماری داشته باشد یا (2) اگر بیمار علامتدار با درد یا علائم غدد درون ریز کنترل نشده باشد. سانیتینیب و اورولیموس درمانهای خط مقدم مورد تأیید FDA برای سرطانهای نورواندوکرین با درجه پایین هستند.
نقش جراح در سرطان با محل اولیه ناشناخته
جراحان در تمام مراحل درمان با بیماران مبتلا به CUP – از تشخیص تا تسکین – تعامل دارند. اغلب، مقدار بافت لازم برای تکمیل مطالعات IHC، سیتوژنتیک و پروفایل مولکولی بر روی نمونهای که از طریق پوست به دست میآید، از مقدار بافت موجود از طریق این روش بیوپسی بیشتر است. اغلب از جراحان خواسته میشود که با انجام بیوپسی اکسیزیونال، مانند لنفادنوپاتی، برای ارزیابی لنفوم یا CUP که نیاز به بافت کافی برای انجام تمام بررسیهای تشخیصی ضروری دارد، در تشخیص کمک کنند. بیماران مبتلا به CUP با یک محل بیماری واحد و بدون شواهدی از متاستازهای دوردست، ممکن است کاندیدای رزکسیون بالقوه درمانی باشند. تعیین اینکه به کدام بیمار و در چه زمانی جراحی به بیمار مبتلا به CUP پیشنهاد شود، چالش برانگیز است. عوامل مؤثر بر این تعیین شامل زیست شناسی تومور، از جمله دوره بدون بیماری؛ بافت منشأ (در صورت امکان شناسایی) و رفتار معمول یک سرطان با تمایز ضعیف از آن نوع بافت؛ پاسخ به شیمی درمانی نئوادجوانت یا ایمونوتراپی؛ وضعیت عملکرد آن بیمار؛ و در نهایت، تأثیر بر کیفیت زندگی بیمار پس از جراحی است.
شیمی درمانی برای سرطان متاستاتیک با محل اولیه ناشناخته
تفسیر دادههای حاصل از آزمایشهای CUP دشوار است زیرا بیماران مبتلا به CUP یک گروه ناهمگن هستند. وقتی شیمیدرمانی به گروههای غیرانتخابی از بیماران مبتلا به سرطان روده بزرگ متاستاتیک (CUP) داده میشود، میتوان میزان بقای کلی ۵ تا ۱۰ درصد در ۵ سال را پیشبینی کرد، که میانگین بقای آن در اکثر مطالعات بین ۶ تا ۱۳ ماه است. بیمارانی که زیرگروههای مطلوب (مثلاً کارسینوماتوز صفاقی یا بیماری غالب غدد لنفاوی) دارند از شیمیدرمانی سود میبرند. به طور سنتی، رژیمهای شیمیدرمانی ترکیبی مبتنی بر سیس پلاتین برای درمان بیماران مبتلا به سرطان روده بزرگ (CUP) استفاده شدهاند. در یک مطالعه فاز II توسط هینزورث و همکارانش، ۵۵ بیمار مبتلا به سرطان روده بزرگ (CUP) هر ۲۱ روز یکبار با پاکلیتاکسل، کربوپلاتین و اتوپوزید خوراکی درمان شدند. اکثر آنها قبلاً درمان نشده بودند و تنها چهار نفر قبلاً تحت شیمیدرمانی قرار گرفته بودند. میزان پاسخ کلی ۴۷٪ بود، میانگین بقای کلی ۱۳.۴ ماه بود و رژیم به خوبی تحمل شد. بریاسولیس و همکارانش. نرخ پاسخدهی و میانگین بقای کلی قابل مقایسهای را در ۷۷ بیمار مبتلا به CUP با پاکلیتاکسل و کربوپلاتین و بدون اتوپوزید خوراکی مشاهده کردند.
در این مطالعه، بیماران مبتلا به بیماری غدد لنفاوی یا پلور و زنان مبتلا به کارسینوماتوز صفاقی، به ترتیب نرخ پاسخدهی بهتر و بقای کلی ۱۳ و ۱۵ ماه داشتند. یک کارآزمایی تصادفی فاز II توسط کولین و همکارانش (گروه مطالعه فرانسوی روی کارسینوماهای با منشا ناشناخته) ۸۰ بیمار را که به طور تصادفی برای دریافت جمسیتابین + سیس پلاتین (GC) یا ایرینوتکان + سیس پلاتین (IC) انتخاب شده بودند، مورد مطالعه قرار داد. هفتاد و هشت بیمار از نظر اثربخشی و سمیت قابل ارزیابی بودند. پاسخهای عینی در ۲۱ بیمار (۵۵٪) در گروه GC و در ۱۵ بیمار (۳۸٪) در گروه IC مشاهده شد. میانگین بقای کلی به ترتیب ۸ و ۶ ماه در گروههای GC و IC بود (میانگین پیگیری ۲۲ ماه). بیماران مبتلا به کارسینوم با تمایز ضعیف، که معادلهای احتمالی سلولهای زایا هستند، به طور سنتی تحت آزمایش رژیم درمانی مبتنی بر سیس پلاتین قرار گرفتهاند.
بیماران مبتلا به سرطان سلول سنگفرشی یا سرطان نورواندوکرین، پاسخ به عوامل شیمیدرمانی به طور قابل توجهی بهتری نسبت به بیماران مبتلا به سایر انواع تومور دارند. نقش شیمیدرمانی خط دوم در CUP به خوبی تعریف نشده است. در عصر حاضر، درمانها بر اساس سرنخهایی از تظاهرات بالینی، ایمونوهیستوشیمی و پاسخ به درمان خط اول انتخاب میشوند.
ایمونوتراپی به سرعت در حال تبدیل شدن به خط مقدم درمان بیماران مبتلا به بیماری موضعی-منطقهای و بیماری متاستاتیک دوردست در بسیاری از انواع سرطان، مانند ملانوما، است و احتمالاً پیامدهایی در آینده برای درمان CUP خواهد داشت. در حال حاضر، موارد استفاده محدودی برای ایمونوتراپی در CUP وجود دارد. با این حال، مهارکنندههای نقاط بازرسی در چندین آزمایش فاز II برای ارزیابی اثربخشی آنها در بیماران مبتلا به بیماری متاستاتیک از مکانهای اولیه شناخته شده، مانند سرطان کولورکتال و سرطان سلول سنگفرشی سر و گردن، مورد استفاده قرار گرفتهاند.
نکته قابل توجه این است که لی و همکارانش در یک آزمایش فاز II کوچک که شامل بیمارانی با نقص ترمیم عدم تطابق صرف نظر از منشأ کولورکتال بود، با میزان بقای بدون پیشرفت مرتبط با ایمنی 78٪، مزایای بالینی مهارکننده نقاط بازرسی پمبرولیزوماب را نشان دادند. اینکه آیا میتوان از مهارکنندههای نقاط بازرسی در سرطانهای CUP با تظاهرات بالای MSI یا پاتوژنز ناشی از ویروس (به عنوان مثال، بیماری گره اینگوینال مثبت HPV) استفاده کرد، هنوز مشخص نیست. اگرچه درمان قطعی برای بسیاری از بیماران مبتلا به CUP یک هدف غیرواقعبینانه است، اما جراحان اغلب در مراقبت تسکینی از چنین بیمارانی مشارکت دارند و در برخی موارد منتخب، در برنامهریزی درمانهای قطعی برای بیماران مبتلا به بیماریهای موضعی-منطقهای نیز دخیل هستند. CUP نمونه بارز پزشکی شخصیسازیشده است و بیماران باید توسط یک تیم چندرشتهای مدیریت شوند تا از بهبود بقا و کیفیت زندگی اطمینان حاصل شود.


بدون دیدگاه