اپیدمیولوژی
سرطان کولورکتال (CRC) یکی از علل اصلی مرگ و میر و عوارض مرتبط با سرطان است. این سرطان سومین سرطان شایع تشخیص داده شده و سومین علت اصلی مرگ و میر ناشی از سرطان در مردان و زنان در ایالات متحده است. سالانه تقریباً ۱۳۴۴۹۰ مورد جدید CRC تشخیص داده میشود که شامل ۹۵۲۷۰ سرطان روده بزرگ و ۳۹۲۲۰ سرطان رکتوم است. تلاشهایی که با هدف پیشگیری، غربالگری و تشخیص زودهنگام انجام شده است، منجر به کاهش قابل توجه شیوع CRC در حدود ۳ تا ۴ درصد در سال در طول ۱۵ سال گذشته شده است. با وجود این پیشرفتها، CRC هنوز هم کمی بیش از ۴۹۰۰۰ مرگ در سال در ایالات متحده و همچنین ۸ درصد از کل مرگ و میرهای ناشی از سرطان را تشکیل میدهد.
در ایالات متحده، خطر ابتلا به CRC در طول عمر حدود ۵ درصد است و مردان در مقایسه با همتایان زن خود ۲۵ درصد بیشتر به آن مبتلا میشوند. سن یک عامل خطر اصلی در ایجاد سرطان کولورکتال پراکنده است. تقریباً 90٪ از کل سرطانهای کولورکتال در بیماران 50 سال یا بیشتر تشخیص داده میشوند. در زمان تشخیص، 40٪ از بیماران بیماری موضعی، 37٪ گسترش منطقهای و 20٪ متاستاز دوردست خواهند داشت. میزان بقای کلی (OS) برای سرطان کولورکتال به شدت به مرحله بیماری در زمان تشخیص وابسته است، به طوری که بقای 5 ساله برای بیماری موضعی، منطقهای و متاستاتیک به ترتیب تقریباً 90٪، 70٪ و 12٪ است. با این حال، دادههای اخیر از پایگاه داده نظارت، اپیدمیولوژی و گزارش نتایج نهایی ایالات متحده (SEER) نشان میدهد که میزان بروز سرطان کولورکتال در بیماران زیر 50 سال در حال افزایش است و این بیماران جوان در مقایسه با کل جمعیت بیماران مبتلا به سرطان کولورکتال، بیشتر با سرطانهای سمت چپ و رکتوم مراجعه میکنند. این بیماران همچنین تمایل دارند با بیماری پیشرفتهتری مراجعه کنند و بسیاری از آنها در زمان تشخیص علامتدار هستند. دستورالعملهای فعلی، غربالگری آندوسکوپی را از سن ۵۰ سالگی برای بیمارانی که در معرض خطر متوسط ابتلا به سرطان کولورکتال (CRC) هستند، توصیه میکنند. در حال حاضر هیچ توصیهای برای غربالگری روتین سرطان کولورکتال در بیماران زیر ۵۰ سال وجود ندارد، مگر اینکه یک سندرم ارثی زمینهای شناخته شده یا سابقه خانوادگی سرطان کولورکتال وجود داشته باشد.
عوامل خطر
سن
سن بالا زمینه را برای ابتلا به سرطان کولورکتال فراهم میکند. بروز سرطان کولورکتال پس از ۴۰ سالگی به تدریج افزایش مییابد و پس از ۵۰ سالگی به صورت تصاعدی بالا میرود. بیش از ۹۰٪ موارد جدید سرطان کولورکتال و ۹۴٪ مرگ و میر ناشی از سرطان کولورکتال در بیماران بالای ۵۰ سال رخ میدهد. بروز سرطان کولورکتال در بیماران بالای ۶۰ سال ۵۰ برابر بیشتر از بیماران کمتر از ۴۰ سال است.
نژاد
در ایالات متحده، بروز و مرگ و میر ناشی از سرطان کولورکتال در بین آمریکاییهای آفریقاییتبار در مقایسه با سایر گروههای قومی/نژادی بالاترین میزان را دارد.
مردان و زنان آمریکایی آفریقاییتبار ۲۰٪ بیشتر از آمریکاییهای سفیدپوست به سرطان کولورکتال مبتلا میشوند و ۴۵٪ بیشتر از همتایان سفیدپوست خود از سرطان کولورکتال میمیرند. میزان بروز و مرگ و میر سرطان روده بزرگ (CRC) در بین سایر گروههای قومی/نژادی اصلی کمتر از میزان مشاهده شده در سفیدپوستان است. اگرچه در دهه گذشته کاهش ملی در میزان سرطان روده بزرگ (CRC) وجود داشته است، اما این کاهش در زیرگروههای جمعیتی نامتناسب بوده است. این اختلاف احتمالاً با تغییرات در دسترسی به غربالگری و روشهای درمانی پیشرفته و همچنین دلایل چند عاملی مرتبط است. به عنوان مثال، آمریکاییهای آفریقاییتبار به طور کلی کمتر از سفیدپوستان احتمال دارد که مناسبترین جراحی، شیمیدرمانی کمکی و پرتودرمانی را پس از تشخیص سرطان دریافت کنند. با این حال، در برخی از محیطهای کارآزمایی بالینی، که تنوع درمان حذف میشود، این تفاوتهای نژادی در بقا از بین میرود. وضعیت اجتماعی-اقتصادی یک عامل مخدوشکننده اصلی است، با استفاده از نوع بیمه به عنوان جایگزینی برای وضعیت اقتصادی، مطالعات نشان دادهاند که بقای 5 ساله برای سرطان روده بزرگ (CRC) در بین بیماران آمریکایی آفریقاییتبار که بیمه خصوصی دارند در مقایسه با افراد بدون بیمه درمانی، 30٪ بیشتر است.
رژیم غذایی
بسیاری از عوامل غذایی در مورد تأثیر آنها بر سرطان روده بزرگ مورد مطالعه قرار گرفتهاند. مصرف گوشت قرمز، گوشت فرآوری شده و چربی حیوانی، و همچنین وجود سطح بالای کلسترول در مدفوع، با افزایش خطر ابتلا به سرطان روده بزرگ (CRC) مرتبط است. در سال ۲۰۱۵، سازمان بهداشت جهانی گوشت قرمز و گوشت فرآوری شده را به عنوان عوامل سرطانزای احتمالی اعلام کرد. علاوه بر این، برخی مطالعات نشان میدهند افرادی که رژیم غذایی کم فیبر طبیعی و کم میوه و سبزیجات دارند، خطر ابتلا به سرطان روده بزرگ (CRC) در آنها بیشتر است. فرض بر این است که تفاوت در مصرف فیبر غذایی به طور قابل توجهی در تفاوتهای جغرافیایی در بروز سرطان روده بزرگ بین آفریقا و کشورهای غربی نقش دارد. علاوه بر این، افزایش خطر ابتلا به سرطان روده بزرگ با مصرف متوسط الکل (۳۰ گرم یا تقریباً ۲ نوشیدنی در روز) نیز مرتبط بوده است. در مقابل، نشان داده شده است که مکملهای فولات در برابر سرطان روده بزرگ (CRC) محافظت ایجاد میکنند. نشان داده شده است که مکملهای کلسیم باعث کاهش تشکیل آدنومهای جدید در بیمارانی که سابقه آدنوم دارند و همچنین کاهش خطر ابتلا به سرطان روده بزرگ میشوند. ویتامینهایی با خواص آنتیاکسیدانی از جمله بتاکاروتن، ویتامینهای A، C، E و سلنیوم مورد مطالعه قرار گرفتهاند و در حال حاضر هیچ دادهی آیندهنگری وجود ندارد که اثر محافظتی این ویتامینها را در صورت دریافت از منابع غذایی نشان دهد، اما مصرف روزانهی مکمل مولتیویتامین، کاهش نسبی خطر ابتلا به سرطان رودهی بزرگ (CRC) را نشان داده است.
فعالیت بدنی و چاقی
عدم فعالیت بدنی و چاقی دو عامل خطر قابل اصلاح مرتبط با سبک زندگی هستند که با ابتلا به سرطان روده بزرگ (CRC) مرتبط هستند و اعتقاد بر این است که در یک سوم موارد سرطان روده بزرگ (CRC) نقش دارند. در چندین مطالعه نشان داده شده است که فعالیت بدنی منظم خطر ابتلا به سرطان روده بزرگ را کاهش میدهد و قویترین شواهد در سرطان روده بزرگ در مقایسه با سرطان رکتوم مشاهده شده است. مکانیسمهای بیولوژیکی هنوز در حال روشن شدن هستند، با این حال، اثر متابولیک فعالیت بر مقاومت به انسولین و تحرک روده در این امر دخیل دانسته شده است. چاقی، به ویژه چربی اضافی مرکزی، با افزایش انسولین در گردش و کاهش حساسیت به انسولین مرتبط است که اعتقاد بر این است که هر دو خطر ابتلا به سرطان را افزایش میدهند.
سیگار کشیدن
سیگار کشیدن در ایجاد پولیپهای آدنوماتوز، به ویژه ضایعات پیشساز آدنوم تهاجمیتر برای سرطان کولورکتال (CRC) نقش دارد. برخی مطالعات نشان دادهاند که سیگار کشیدن طولانی مدت خطر ابتلا به سرطان کولورکتال، به ویژه سرطان رکتوم، را افزایش میدهد و همچنین میانگین سن شروع سرطان کولورکتال را در افراد سیگاری پایینتر نشان میدهد.
داروها
چندین دارو اثرات محافظتی برای سرطان کولورکتال نشان دادهاند. نشان داده شده است که درمان جایگزینی هورمون به طور قابل توجهی مرگ و میر ناشی از سرطان کولورکتال را در زنان کاهش میدهد. آسپرین و سایر داروهای ضدالتهاب غیراستروئیدی نیز اثرات محافظتی نشان دادهاند. مطالعات اخیر با سولینداک و سلکوکسیب، مهارکننده انتخابی سیکلواکسیژناز-۲، توانایی این داروها را در ایجاد پسرفت پولیپهای روده بزرگ در بیماران مبتلا به FAP نشان داده است. با این حال، مهارکنندههای سیکلواکسیژناز-۲ با افزایش خطر عوارض قلبی عروقی همراه بودهاند. بنابراین، نقش آنها در پیشگیری شیمیایی هنوز مشخص نیست.
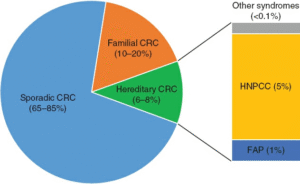 |
| شکل ۱۲.۱ نمودار دایرهای که نسبت موارد سرطان روده بزرگ (CRC) را که گمان میرود پراکنده، خانوادگی یا ناشی از سندرمهای سرطان ارثی باشند، نشان میدهد. HNPCC، سرطان روده بزرگ ارثی غیرپولیپی؛ FAP، پولیپوز آدنوماتوز خانوادگی. |
تومورزایی کولورکتال
اکثر سرطانهای کولورکتال به صورت سرطانهای پراکنده در بیمارانی بدون سابقه خانوادگی قابل توجه سرطان کولورکتال ایجاد میشوند (شکل 12.1). 10 تا 20 درصد دیگر با استعداد خانوادگی بدون جهش ارثی قابل شناسایی مرتبط هستند. تنها بخش کوچکی از موارد سرطان کولورکتال را میتوان مستقیماً به سندرمهای ژنتیکی شناخته شده نسبت داد، به طوری که سرطان کولورکتال ارثی واقعی کمتر از 10 درصد از بیماران مبتلا به این بیماری را تشکیل میدهد.
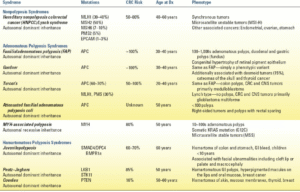
سندرمهای ارثی سرطان کولورکتال از جهشهای ارثی در سلولهای زایا ناشی میشوند و معمولاً با تظاهرات بالینی کاملاً مشخص همراه هستند. سرطان کولورکتال غیرپولیپی ارثی (HNPCC) و پولیپ آدنوماتوز خانوادگی (FAP) شایعترین سندرمهایی هستند که در عمل با آنها مواجه میشویم. سایر سندرمهای نادرتر که مستعد سرطان کولورکتال هستند و در جدول 12.1 ذکر شدهاند، به طور خلاصه در زیر مورد بحث قرار میگیرند.
سندرمهای ارثی سرطان روده بزرگ (CRC)
سرطان روده بزرگ غیرپولیپی ارثی (CRC)
سندرم HNPCC یا لینچ شایعترین سندرم ارثی سرطان رکتوم است. گزارش شده است که 2 تا 5 درصد از کل سرطانهای روده بزرگ (CRC) را تشکیل میدهد (شکل 12.1). این سندرم اتوزومال غالب ناشی از جهشهای رده زایا در ژنهای ترمیم عدم تطابق DNA (MMR) است که منجر به تجمع جهشهایی میشود که زمینهساز ایجاد سرطانهای روده بزرگ، آندومتر و سایر سرطانها میشوند. یکی از نشانههای مولکولی جهشهای MMR، یافتن ناپایداری ریزماهواره در تومور است. جهش در MLH1 و MSH2 تقریباً 90 درصد از کل بیماران سندرم لینچ را تشکیل میدهد و جهش در MSH6، PMS2 و EPCAM بقیه موارد را تشکیل میدهد. بیماران معمولاً یک جهش ژن MMR رده زایا را به ارث میبرند و متعاقباً یک جهش غیرفعالکننده در آلل باقیمانده را کسب میکنند. به همین دلیل، نفوذ ژن در خانوادهها از 30 تا 70 درصد متغیر است. خطر ابتلا به سرطان کولورکتال (CRC) تا دهههای چهارم و پنجم زندگی به ۸۰٪ میرسد. در زمان تشخیص، تقریباً ۲۰٪ از بیماران تومورهای همزمان خواهند داشت، بنابراین ارزیابی دقیق کل روده بزرگ و راست روده قبل از مداخله جراحی باید در بیماران مبتلا به HNPCC که با سرطان مراجعه میکنند، انجام شود. هنگام برنامهریزی برای برداشتن جراحی، باید گسترش برداشتن به فراتر از کولکتومی سگمنتال با هدف جلوگیری از CRC های آینده در نظر گرفته شود. در واقع، حدود ۲۰٪ تا ۶۰٪ از بیماران مبتلا به CRC پس از برداشتن اولیه، در صورت عدم انجام کولکتومی ساب توتال، دچار CRC متاکرونوس میشوند. در بیماران مبتلا به سندرم لینچ، مدت زمانی که طول میکشد تا یک آدنوم به بدخیمی تبدیل شود، کوتاهتر از بازه زمانی مشاهده شده در بیماران مبتلا به سرطان روده بزرگ پراکنده است. بنابراین، پاکسازی آندوسکوپی همه آدنومها در بیماران مبتلا به سندرم لینچ بسیار مهم است. یکی دیگر از نشانههای احتمال اینکه سندرم لینچ عامل محرک اصلی تومورزایی باشد، ایجاد پولیپهای آدنوماتوز در سنین پایین است. HNPCC همچنین خطر ابتلا به سرطانهای دیگر از جمله بدخیمیهای آندومتر، تخمدان، معده و کبد و صفرا را افزایش میدهد.
| جدول 12.1سندرمهای ژنتیکی با استعداد ارثی برای ابتلا به سرطان کولورکتال |
 |
در مقایسه با سرطان کولورکتال تکگیر، بیماران مبتلا به HNPCC با سرطانهای سمت راست بیشتری (60 تا 70 درصد در نزدیکی خم طحال رخ میدهند)، در سنین پایینتر (حدود 45 سال) مراجعه میکنند و میزان تومورهای متاکرونوس و همزمان (20٪) در آنها افزایش مییابد. اختلال در ترمیم DNA منجر به خطاهای تکثیر تکرار میکروستلایت میشود که بدون کنترل باقی میمانند و در نتیجه ژنهای سرکوبگر تومور را غیرفعال کرده و منجر به بیثباتی ژنتیکی میشوند. این سرطانهای حاصل با سطح بالایی از بیثباتی میکروستلایت (MSI-H) مشخص میشوند. به طور کلی، آنها در مرحله پایینتر تومور بروز میکنند و در مقایسه با تومورهای پایدار میکروستلایت، پیشآگهی کلی بهتری دارند.
یک چالش عمده در مدیریت بیماران مبتلا به HNPCC شناسایی افرادی است که باید آزمایش شوند. سابقه خانوادگی دقیقی باید در تمام بیماران مبتلا به CRC گرفته شود و ممکن است شرایط پرخطری را شناسایی کند که در آن بیماران از مشاوره ژنتیکی بهرهمند میشوند. افراد بالقوه مبتلا را میتوان با غربالگری با استفاده از معیارهای آمستردام یا دستورالعملهای بتسدا (جدول 12.2) نیز شناسایی کرد. اگرچه این معیارها و دستورالعملها فاقد ویژگی هستند، اما با حساسیت 60 تا 94 درصد برای شناسایی افراد مبتلا به HNPCC همراه هستند. در مرکز سرطان MD Anderson (MDACC)، ما از غربالگری جهانی، آزمایش بیان پروتئین ژن MMR در تمام تومورهای کولورکتال حمایت میکنیم. در صورت مشاهده کاهش بیان پروتئین، مشاوره ژنتیکی و آزمایش تأییدی ژرملاین باید انجام شود. درمان HNPCC با نظارت زودهنگام آغاز میشود. غربالگری کولونوسکوپی در افراد مبتلا باید از 20 تا 25 سالگی آغاز شود و هر 1 تا 2 سال تکرار شود. درمان جراحی بیماران مبتلا به HNPCC و سرطان روده بزرگ تأیید شده باید به نفع کولکتومی سابتوتال با آناستوموز ایلئورکتال (IRA) باشد. نظارت سالانه بر رکتوم باقی مانده پس از آن توصیه میشود. هیسترکتومی پیشگیرانه و سالپنگواوفورکتومی دو طرفه باید به عنوان یک گزینه در زنان پس از اتمام فرزندآوری مورد بحث قرار گیرد.
پولیپوز آدنوماتوز خانوادگی
FAP دومین سندرم ارثی شایع سرطان روده بزرگ است که حدود ۱٪ از کل سرطانهای روده بزرگ را تشکیل میدهد. این یک اختلال ژنتیکی اتوزومال غالب است که از جهشهای رده زایشی در APC ناشی میشود. FAP کلاسیک با صدها تا هزاران آدنوم روده بزرگ که از نوجوانی شروع میشوند، بروز میکند که تقریباً به طور جهانی تا دهه چهارم زندگی به سرطان روده بزرگ تبدیل میشوند.
بیشتر بیماران سابقه قوی سرطانهای روده بزرگ اولیه در بستگان درجه یک و دو خود را دارند، اگرچه حدود ۲۵٪ از بیماران به دلیل جهشهای “از نو” در ژن APC به عنوان فرد مبتلا مراجعه میکنند. میزان بروز سرطان روده بزرگ در طول عمر در بیماران مبتلا به FAP به ۱۰۰٪ نزدیک میشود.
جراحی پیشگیرانه، به ویژه در بیماران مبتلا به FAP کلاسیک، برای کاهش مرگ و میر مرتبط با سرطان روده بزرگ ضروری است. جراحی پیشگیرانه باید زمانی در نظر گرفته شود که بار پولیپ از توانایی پاکسازی یا نظارت آندوسکوپی فراتر رود، زمانی که شواهدی از دیسپلازی وجود داشته باشد، و با ترجیح بیمار، اما معمولاً تا دهه چهارم.
جراحی پیشگیرانه
باید یا پروکتوکولکتومی کامل با آناستوموز کیسه ایلئوآنال یا کولکتومی کامل شکمی با آناستوموز ایلئورکتال را در نظر بگیرد و باید بین پولیپ و بار بیماری در رکتوم، وسعت جراحی و کیفیت زندگی طولانی مدت تعادل برقرار کند. برداشتن پیشگیرانه کولورکتال باید با نظارت مکرر بر دستگاه گوارش باقی مانده برای شناسایی سایر پولیپهای پیش سرطانی پیگیری شود. اگرچه تا 90٪ از بیماران میتوانند در دستگاه گوارش فوقانی، به ویژه دوازدهه، پولیپ ایجاد کنند، اما تنها حدود 5٪ از پولیپهای دوازدهه به سرطانهای تهاجمی تبدیل میشوند. آدنوکارسینوم دوازدهه شایعترین علت مرگ در بیماران FAP است که جراحی پیشگیرانه کولورکتال داشتهاند.
انواع FAP کلاسیک، که از جهشهای ژن APC نیز ناشی میشوند، شرح داده شدهاند و به طور مشابه مستعد ابتلا به سرطان کولورکتال هستند (جدول 12.1). بین شدت بیماری و ماهیت جهشهای APC همبستگی ژنوتیپ-فنوتیپ وجود دارد. کولیت پولیپ آدنوماتوز ضعیفشده (aFAP) اغلب به عنوان یک نوع کمتر تهاجمی FAP توصیف میشود. این بیماران پولیپهای کمتری ایجاد میکنند که معمولاً به روده بزرگ پروگزیمال محدود میشوند و به ندرت رکتوم را تحت تأثیر قرار میدهند. سرطانهای کولورکتال میتوانند در اواخر دهه پنجم زندگی بروز کنند.
| جدول 12.2 معیارهای آمستردام و دستورالعملهای بتسدا |
 |
سایر سندرمهای ارثی سرطان کولورکتال
جدول 12.1 خلاصهای از سایر سندرمهای ارثی که زمینهساز ابتلا به سرطان کولورکتال هستند را ارائه میدهد. پولیپوز مرتبط با MYH یک اختلال اتوزومال مغلوب است که از جهشهای دو آللی رده زایشی در MYH، یک ژن ترمیم برش پایه، ناشی میشود. به همین دلیل، بیماران معمولاً سابقه خانوادگی سرطان در نسلهای مختلف ندارند، اما اکثر آنها قبل از 60 سالگی به سرطان کولورکتال مبتلا میشوند. سایر سندرمها منجر به هامارتومهای روده بزرگ و رکتوم با خطر متغیر ابتلا به سرطان کولورکتال در طول زندگی میشوند. SMAD4، PTEN و STK11 چندین ژن دخیل در ابتلا به این تومورها هستند و همچنین در ابتلا به سرطان کولورکتال پراکنده نقش دارند.
CRC پراکنده
پیشرفتها در زیستشناسی مولکولی دانش ما را در مورد وقایع ژنتیکی و اپیژنتیکی که منجر به تومورزایی CRC میشوند، افزایش داده است. شبکه اطلس ژنوم سرطان (TCGA) در تجزیه و تحلیل مولکولی جامع اخیر خود از سرطان روده بزرگ (CRC) نشان داد که سرطانهای روده بزرگ و رکتوم از نظر مولکولی غیرقابل تشخیص هستند و دو زیرگروه مجزا را شناسایی کردند؛ غیر جهشیافته و جهشیافته با امضاهای ژنتیکی منحصر به فرد. این تحقیقات و سایر تحقیقات منجر به شناسایی مسیرهای متعددی شده است که منجر به توسعه CRC میشوند (شکل 12.2). مسیر کلاسیک آدنوما-توکارسینوما در ابتدا توسط وگلشتاین و همکارانش توصیف شد. تقریباً 70٪ از سرطانهای روده بزرگ پراکنده از طریق این پیشرفت آدنوما به کارسینوما ایجاد میشوند که ناشی از از دست دادن ژنهای سرکوبگر تومور APC و/یا p53 با تجمع بیثباتی کروموزومی در طول زمان است. مسیر دوم شامل از دست دادن ترمیم عدم تطابق DNA است و با جهشهای ژرملاین دیده شده در سندرم لینچ یا متیلاسیون اکتسابی MLH1 نشان داده میشود. به نظر میرسد BRAF از طریق مسیر سوم عمل میکند؛ تومورهای مسیر دندانهدار/متیلاتور با متیلاسیون جزایر CpG مشخص میشوند که باعث خاموش شدن ژنهای سرکوبگر تومور حیاتی میشوند و در نتیجه تومورهای فنوتیپ متیلاتور جزیره CpG (CIMP) ایجاد میشوند. کنسرسیوم زیرگروهبندی سرطان کولورکتال (CRCSC) برای توصیف بیشتر ویژگیهای ژنتیکی و اپیژنتیکی سرطان کولورکتال با ادغام وضعیت جهش تومور، تغییرات تعداد کپی DNA، متیلاسیون ژن، میکروRNA و بیان پروتئین تلاش کرده است.
این تلاش، ناهمگونی تومور سرطان کولورکتال را بهتر روشن کرده و ممکن است پیامدهای مستقیمی بر پیشآگهی بیمار و پاسخ به درمانها داشته باشد. آنها چهار زیرگروه مولکولی اجماعی (CMS) متمایز را با ویژگیهای مولکولی، فنوتیپ تومور و پیشآگهی منحصر به فرد توصیف میکنند (جدول 12.3). سرطانهای کولورکتال CMS1 عمدتاً تومورهای با MSI بالا هستند و تمایل دارند که جهشهای BRAF بیش از حد، متیله و/یا غنی شده باشند. CMS2 و CMS4 توسط بیثباتی کروموزومی هدایت میشوند که معمولاً منجر به تومورهای پایدار ریزماهوارهای ناشی از تغییرات تعداد کپی بالا میشود. تومورهای CMS4 خواص پیشآنگیزایی را نشان میدهند که توسط مسیرهای متعددی از جمله سیگنالینگ فاکتور رشد اندوتلیال عروقی (VEGF) هدایت میشوند. به همین دلیل، این تومورها با پیشآگهی ضعیفی که به صورت عود زودهنگام و نارسایی دور از دسترس آشکار میشود، مرتبط هستند. تومورهای CMS3 توسط برنامهریزی مجدد متابولیک هدایت میشوند و تغییرات تعداد کپی کمتری را نشان میدهند و جهشهایی را که بر سازگاری متابولیکی مانند جهشهای KRAS و PIK3CA تأثیر میگذارند، غنی میکنند.
در حالی که تلاشهای TCGA، CRCSC و دیگران به طور قابل توجهی درک ما از سرطانزایی CRC را بهبود بخشیده است، درک ما از چشمانداز جهشی CRC همچنان در حال تکامل است. همچنان نیاز به شناسایی و اعتبارسنجی الگوهای جدید ترجمه برای زیرگروه دقیق CRC وجود دارد تا امکان یک رویکرد واقعاً شخصیسازی شده برای درمان فراهم شود.
غربالگری سرطان کولورکتال
دستورالعملها و روشهای غربالگری
میزان کلی ابتلا به سرطان کولورکتال در ایالات متحده رو به کاهش است؛ این امر تا حد زیادی به غربالگری مبتنی بر جمعیت برای سرطان کولورکتال نسبت داده شده است. همانطور که قبلاً بحث شد، اکثریت قریب به اتفاق سرطانهای کولورکتال از طریق مسیر کلاسیک تبدیل آدنوم به کارسینوم ایجاد میشوند، به طوری که شناسایی و برداشتن به موقع ضایعات پیشبدخیم میتواند از پیشرفت به سرطان جلوگیری کند.
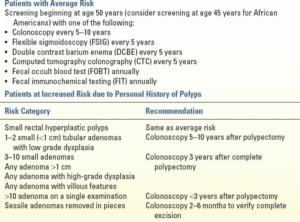
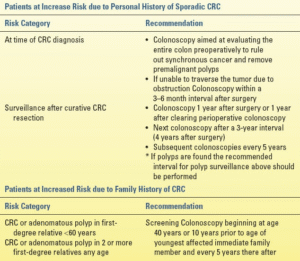
دستورالعملهای فعلی برای غربالگری و نظارت بر سرطان کولورکتال، همانطور که توسط کارگروه چند جامعهای ایالات متحده توصیه شده است، در جدول 12.4 آمده است. غربالگری باید در سن 50 سالگی برای بیمارانی که خطر ابتلا به سرطان کولورکتال متوسط دارند، آغاز شود. آمریکاییهای آفریقاییتبار بیشتر از سایر جمعیتها در معرض ابتلا به سرطان کولورکتال هستند و تمایل دارند در سنین پایینتری بروز کنند. به همین دلیل، برخی از متخصصان توصیه میکنند که غربالگری در این جمعیت در سن 45 سالگی آغاز شود. اهداف غربالگری، تشخیص سرطانهای اولیه و پیشگیری از سرطان با یافتن و برداشتن آدنومها است. عواملی که زمینهساز ابتلا به سرطان کولورکتال (CRC) بودند شامل سابقه شخصی پولیپ، سابقه شخصی سرطان کولورکتال یا سابقه خانوادگی سرطان کولورکتال یا پولیپ بودند. بیمارانی که سندرمهای ارثی سرطان کولورکتال شناخته شده یا مشکوک دارند و بیمارانی که بیماری التهابی روده طولانی مدت دارند، در معرض خطر بالای ابتلا به سرطان کولورکتال قرار دارند. این بیماران ملاحظات ویژهای را میطلبند که در جدول 12.4 خلاصه شده است.
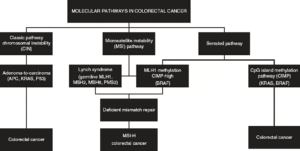 |
| شکل ۱۲.۲ سرطانهای کولورکتال (CRC) از طریق سه مسیر مولکولی مجزا ایجاد میشوند. مسیر کلاسیک یا ناپایداری کروموزومی (CIN) مسئول ۳۰ تا ۷۰ درصد از سرطانهای کولورکتال ناشی از آدنوم پیشرونده به کارسینوم است. جهشهای ترمیم عدم تطابق رده ژرمینال منجر به سندرم لینچ میشود که تقریباً یک چهارم از کل سرطانهای کولورکتال MSI را تشکیل میدهد. مسیر Serrated/Methylated توسط هیپرمتیلاسیون هدایت میشود. |
| جدول 12.3زیرگروه مولکولی اجماعی (CMS) طبقهبندی سرطان کولورکتال (CRC) |
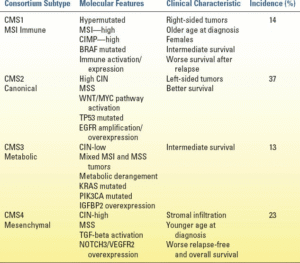 |
در حال حاضر روشهای متعددی برای غربالگری سرطان کولورکتال (CRC) در بیماران با خطر متوسط با اثربخشی و حساسیت اثباتشده به کار گرفته میشود. ابزارهای غربالگری آندوسکوپیک اغلب مورد استفاده قرار میگیرند زیرا گزینههای تشخیصی و درمانی ارائه میدهند. سیگموئیدوسکوپی انعطافپذیر (FSIG) امکان بررسی آندوسکوپی روده بزرگ و راست روده را فراهم میکند. مطالعات مورد-شاهدی، کاهش 60 تا 80 درصدی در مرگ و میر ناشی از سرطان کولورکتال را با غربالگری روتین FSIG نسبت به نمونههای غربالگری نشده نشان دادهاند. این به این دلیل است که بیشتر سرطانهای کولورکتال پراکنده از روده بزرگ یا راست روده چپ ناشی میشوند. با این حال، FSIG فقط برای ناحیه مورد بررسی مؤثر است و باید با قرار دادن آندوسکوپی تا حداقل 40 سانتیمتر یا تا خمیدگی طحال انجام شود تا کافی تلقی شود. FSIG به عنوان یک ابزار غربالگری به دلیل سهولت انجام آن، مورد توجه قرار گرفته است. این روش اغلب در مطب و بدون آرامبخش انجام میشود و بیماران اغلب تحت آمادهسازی ساده روده به شکل تنقیه قرار میگیرند. به عنوان یک آزمایش غربالگری، سیگموئیدوسکوپی انعطافپذیر، در صورت طبیعی بودن، باید هر 5 سال تکرار شود. به دلیل ارزیابی محدود کولون، FSIG اغلب همراه با ارزیابی رادیوگرافی کولون پروگزیمالتر یا آزمایش خون مخفی مدفوع سالانه استفاده میشود. اگر در FSIG پولیپ پیدا شود، کولونوسکوپی کامل ضروری است.
کولونوسکوپی یکی از رایجترین روشهای انجام شده در ایالات متحده است. این شامل بررسی کل رکتوم و کولون تا دریچه ایلئوسکال است. با توجه به اینکه تا 40٪ از سرطانهای کولون در پروگزیمال خمیدگی طحالی ایجاد میشوند، کولونوسکوپی حساسیت بیشتری در تشخیص سرطان کولورکتال نسبت به FSIG ارائه میدهد. اکثر مطالعاتی که از کولونوسکوپی غربالگری در بیماران با خطر متوسط استفاده میکنند، به طور متوسط 30٪ از ضایعات نئوپلاستیک را تشخیص میدهند که اکثر آنها قابل برداشتن با آندوسکوپی هستند.
محدودیتهای کولونوسکوپی شامل نیاز به آمادهسازی طولانی مدت روده و محدودیتهای غذایی، نیاز به آرامبخش و نظارت و تنوع گسترده در مهارت اپراتور است. هزینه نیز یک ملاحظه مهم است، با این حال، مطالعات نشان دادهاند که اگر فاصله زمانی ۱۰ ساله استفاده شود و اگر روده بزرگ به طور مناسب از پولیپها پاک شود، کولونوسکوپی غربالگری مقرون به صرفه است. با وجود این محدودیتها، کولونوسکوپی همچنان استاندارد طلایی برای معاینه روده بزرگ و راست روده است. تمام یافتههای مثبت یافت شده با سایر روشهای غربالگری نیاز به کولونوسکوپی برای ارزیابی قطعی و/یا پاکسازی روده بزرگ دارند.
| جدول 12.4کارگروه چند جامعهای ایالات متحده در مورد دستورالعملهای CRC برای غربالگری و نظارت بر کولونوسکوپی |
 |
 |
 |
خون در مدفوع یک یافته غیر اختصاصی است اما میتواند به آدنومهای بزرگ یا تومورهای مخفی اشاره داشته باشد. آزمایشهای خون مخفی مدفوع (FOBT) میتوانند مبتنی بر گایاک (gFOBT) یا مبتنی بر ایمونوهیستوشیمی (FIT) باشند. آزمایشهای مبتنی بر گایاک بر اکسیداسیون با واسطه سودوپری اکسیداز متکی هستند که در حضور هم یا هموگلوبین کاتالیز میشود. FIT از آنتیبادیها برای تشخیص گلوبولین انسانی استفاده میکند. کارآزماییهای تصادفی آیندهنگر نشان دادهاند که غربالگری خون مخفی مدفوع و به دنبال آن کولونوسکوپی، سرطانها را در مراحل اولیه در مقایسه با بیمارانی که غربالگری نمیشوند، تشخیص میدهد. مطالعه کنترل سرطان روده بزرگ مینه سوتا، بقای مرتبط با سرطان را به طور قابل توجهی بهبود یافته نشان داد و یک متاآنالیز از کارآزماییهای تصادفی FOBT نشان میدهد که آزمایش خون مخفی با کاهش 15 تا 43 درصدی در میزان مرگ و میر ناشی از سرطان کولورکتال همراه است. با این حال، حساسیت FOBT بسیار متغیر است. به همین دلیل، اغلب برای تکمیل آزمایش با حساسیت قابل قبول، به دو تا سه نمونه نیاز است. اگر FOBT مثبت باشد، باید کولونوسکوپی کامل انجام شود.
تنقیه باریم با کنتراست دوگانه (DCBE) کمتر از کولونوسکوپی برای غربالگری استفاده میشود و میتواند سرطان کولورکتال و پولیپهای بزرگتر از ۱ سانتیمتر را با دقتی برابر با کولونوسکوپی تشخیص دهد. این روش در بیمارانی که از انجام کولونوسکوپی کامل تا سکوم امتناع میکنند یا نمیتوانند، به عنوان کمکی برای سیگموئیدوسکوپی انعطافپذیر، برای ارزیابی بقیه روده بزرگ و برای چرخشهای دشوار در روده بزرگ استفاده شده است. مشکل این روش این است که ضایعات شناسایی شده توسط DCBE نیاز به ارزیابی و مداخله بیشتر دارند و این امر باعث کاهش هزینه-اثربخشی روش میشود. توصیههای غربالگری فعلی انجمن سرطان آمریکا برای DCBE هر ۵ سال یکبار و در صورت مثبت بودن نتایج آزمایش، کولونوسکوپی بعدی است.
کولونوگرافی توموگرافی کامپیوتری (CT) (کولونوسکوپی مجازی) به عنوان تکنیکی برای تشخیص پولیپهای روده بزرگ در جمعیت غربالگری ظهور کرده است که از بازسازی سهبعدی روده بزرگ متسع شده با هوا استفاده میکند. در مرکز پزشکی ملی نیروی دریایی، در ۱۲۲۳ بزرگسال با خطر متوسط که متعاقباً تحت کولونوسکوپی معمولی (اپتیکال) قرار گرفتند، کولونوسکوپی مجازی در تشخیص ضایعات مربوطه به خوبی یا بهتر از کولونوسکوپی معمولی بود. یک مطالعه چند نهادی جدیدتر که بر روی ۲۶۰۰ بیمار بدون علامت ۵۰ سال یا بالاتر انجام شد، نشان داد که کولونوگرافی سیتی ۹۰٪ از بیماران مبتلا به آدنوم یا سرطان با قطر ۱۰ میلیمتر یا بیشتر را شناسایی کرده است و دادههای منتشر شده در مورد نقش کولونوگرافی سیتی در غربالگری بیماران با خطر متوسط ابتلا به سرطان کولورکتال را بیشتر تقویت کرد. با این حال، برخی از محدودیتهای اصلی شامل نیاز به آمادهسازی کامل روده و کولونوسکوپی پیگیری برای تشخیص بافت ناهنجاریهای رادیوگرافی بود. از آنجا که کولونوسکوپی مجازی از نظر رادیولوژیست به طور قابل توجهی زمانبر و پرزحمت است، تحقیقات فعال در مورد روشهای خودکارسازی فرآیند ارزیابی در حال انجام است. توصیههای غربالگری فعلی انجمن سرطان آمریکا برای کولونوسکوپی مجازی هر ۵ سال یکبار و در صورت یافتن ضایعه، کولونوسکوپی بعدی است. آنتیژن کارسینوامبریونیک (CEA) یک گلیکوپروتئین است که در غشاهای سلولی بسیاری از بافتها، از جمله سرطان روده بزرگ (CRC) یافت میشود. مقداری از این آنتیژن وارد گردش خون میشود و با روش رادیوایمونواسی سرم شناسایی میشود. CEA همچنین در مایعات مختلف بدن، ادرار و مدفوع قابل تشخیص است. افزایش CEA سرم به طور خاص با سرطان روده بزرگ (CRC) مرتبط نیست. سطوح غیرطبیعی و بالای آن همچنین در سرم بیماران مبتلا به بدخیمیهای پانکراس، سینه، تخمدان، غده پروستات، سر و گردن، مثانه و کلیه یافت میشود. سطح CEA تقریباً در 30 تا 80 درصد از بیماران مبتلا به سرطان روده بزرگ بالا است، اما کمتر از نیمی از بیماران مبتلا به بیماری موضعی، CEA مثبت هستند. بنابراین، CEA نقشی در غربالگری ضایعات اولیه ندارد. نتایج مثبت کاذب در بیماریهای خوشخیم (ریه، کبد و روده) رخ میدهد. سطح CEA در افراد سیگاری نیز افزایش مییابد. در مجموع، 60 درصد از تومورها تنها با غربالگری CEA تشخیص داده نمیشوند.
اندیکاسیونهای مداخله آندوسکوپی در غربالگری
پولیپها
پولیپها شایعترین اندیکاسیون برای مداخله آندوسکوپی در طول کولونوسکوپی هستند. همانطور که قبلاً ذکر شد، سرطان کولورکتال اغلب از پولیپها ناشی میشود، با این حال پولیپها متفاوت هستند و خطرات مختلفی از پیشرفت بدخیمی را به همراه دارند. پولیپهای کولورکتال از نظر بافتشناسی به صورت نئوپلاستیک (که ممکن است خوشخیم یا بدخیم باشد)، پولیپهای آدنوماتوز (از جمله آدنوماتوز دندانهدار) یا پولیپهای غیر نئوپلاستیک (از جمله هایپرپلاستیک، مخاطی، التهابی و هامارتوماتوز) طبقهبندی میشوند. پولیپهای آدنوماتوز تقریباً در 33٪ از جمعیت عمومی تا سن 50 سالگی و تقریباً در 50٪ از جمعیت عمومی تا سن 70 سالگی یافت میشوند. اکثر ضایعات کمتر از 1 سانتیمتر اندازه دارند، و 60٪ از افراد یک آدنوم واحد و 40٪ ضایعات متعدد دارند. شصت درصد از ضایعات در دیستال خم طحال قرار دارند. پولیپها میتوانند از طریق مسیرهای مولکولی کلاسیک یا دندانهدار که قبلاً مورد بحث قرار گرفت، به سرطان کولورکتال تبدیل شوند.
مطالعه ملی پولیپ نشان داد که برداشتن پولیپهای آدنوماتوز به وسیله کولونوسکوپی به طور قابل توجهی خطر ابتلا به … را کاهش میدهد. پولیپها در ۶۰٪ از بیماران با سرطان روده بزرگ (CRC) همراه هستند و با افزایش بروز نئوپلاسمهای کولون همزمان و غیر همزمان همراه هستند.
بیماران مبتلا به سرطان اولیه و یک پولیپ منفرد مرتبط، در مقایسه با بیماران دارای پولیپهای متعدد، میزان کمتری از ضایعات همزمان و غیر همزمان دارند. سیر طبیعی پولیپها از رویکرد تهاجمی برای برداشتن به موقع آنها پشتیبانی میکند: سرطان مهاجم در ۲۴٪ از بیماران مبتلا به پولیپهای درمان نشده در محل آن پولیپ در عرض ۲۰ سال ایجاد میشود. خطر بدخیمی مرتبط با بافتشناسی و اندازه پولیپ متفاوت است.
سه نوع بافتشناسی اصلی پولیپهای آدنوماتوز وجود دارد (جدول ۱۲.۵). آدنومهای لولهای با توزیع یکسان در سراسر روده بزرگ یافت میشوند و کمترین خطر بدخیمی مرتبط را دارند. آدنومهای پرزدار تمایل به رکتوم دارند. آنها بسیار کمتر رایج هستند اما ۳۵ تا ۴۰ درصد خطر ابتلا به بدخیمی زمینهای را دارند. پولیپها ممکن است پایهدار (معمولاً لولهای یا توبولوویلوس)، بیساقه (معمولاً توبولوویلوس یا ویلوس) یا غیرپولیپوئید (صاف یا فرورفته) باشند.
تشخیص نئوپلاسمهای غیرپولیپوئیدی به دلیل شباهتهای ظریف با مخاط طبیعی دشوارتر است. نشان داده شده است که ضایعات غیرپولیپوئید فرورفته در زمان تشخیص، خطر بالایی برای سرطان دارند. اندازه پولیپ و درجه دیسپلازی نیز با پتانسیل بدخیمی همبستگی دارند. آدنومهای کوچک (کمتر از 1 سانتیمتر) تنها در 1.3٪ موارد با بدخیمی همراه هستند، در حالی که آدنومهای بزرگتر از 2 سانتیمتر 46٪ موارد بدخیمی دارند. به طور مشابه، درجه بالاتر دیسپلازی با افزایش خطر بدخیمی همراه است.
پولیپهای آدنوماتوز با دیسپلازی خفیف، متوسط و شدید، به ترتیب در 5.7٪، 18٪ و 34.5٪ موارد، دارای سلولهای بدخیم در برداشتن کامل پولیپ هستند.
| جدول12.5 پولیپهای نئوپلاستیک و خطر بدخیمی |
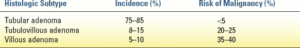 |
دیسپلازی درجه بالا، آدنومهای به شدت دیسپلاستیک را مشخص میکند که در آنها «تحول بدخیم از طریق مخاط ماهیچهای نفوذ نکرده است» و بنابراین این یافته خطر تهاجم عمیقتر یا انتشار به غدد لنفاوی را به همراه ندارد. تقریباً 5 تا 7 درصد از پولیپهای آدنوماتوز حاوی دیسپلازی درجه بالا و 3 تا 5 درصد در زمان تشخیص حاوی کارسینوم مهاجم هستند. افزایش دیسپلازی و پتانسیل بدخیمی با افزایش اندازه، جزء پرزدار و سن بیمار مرتبط است. اگر پولیپی حاوی دیسپلازی درجه بالا به طور کامل از طریق آندوسکوپی برداشته شود، ممکن است بیمار درمان شده در نظر گرفته شود.
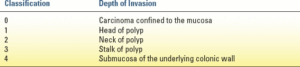
به طور کلی، 8.5 تا 25 درصد از پولیپهای حاوی کارسینوم مهاجم به غدد لنفاوی منطقهای متاستاز میدهند. ویژگیهای پاتولوژیک نامطلوب بدخیمی، احتمال درگیری غدد لنفاوی منطقهای با تومور را افزایش میدهد و شامل (الف) تمایز ضعیف، (ب) تهاجم عروقی و/یا لنفاوی، (ج) تهاجم به زیر زیر مخاط، و (د) حاشیه برداشت مثبت است که با وجود تومور در فاصله 1 تا 2 میلیمتری از حاشیه برش خورده و/یا وجود سلولهای تومور در دیاترمی حاشیه برش خورده تعریف میشود. تقریباً 4 تا 8 درصد از پولیپهای بدخیم تمایز ضعیفی دارند. ضایعات تمایز ضعیف (درجه 3) در مقایسه با ضایعات تمایز یافته خوب و متوسط (به ترتیب درجه 1 و 2) با بروز بیشتر درگیری لنفاوی عروقی و عود بیماری همراه هستند. وجود یک یا چند مورد از این ویژگیهای نامطلوب باید ارزیابی برای برداشت جراحی را ضروری کند. عمق تهاجم یک عامل پیشآگهی مهم برای درگیری غدد لنفاوی مزانتریک با سرطان تهاجمی ناشی از پولیپ است. در سال 1985، هاگیت و همکاران.
سطح تهاجم را از سر پولیپ تا زیر مخاط دیواره روده بزرگ زیرین طبقهبندی کردند (جدول 12.6). در یک تحلیل چند متغیره، تنها تهاجم به زیر مخاط دیواره روده زیرین (سطح 4) یک عامل پیشآگهی مهم بود. این با مطالعات پاتولوژیک قبلی که نشان دادهاند کانالهای لنفاوی به بالای مخاط ماهیچهای نفوذ نمیکنند، مطابقت دارد. اگرچه این یافتهها توسط مطالعات دیگر تأیید شدهاند، اما اغلب عوامل پیشآگهی نامطلوب متعددی در بیماران با سطوح بالاتر تهاجم (یعنی سطوح 3 و 4) مشاهده میشود که تعیین عمق را به عنوان مهمترین عامل دشوار میکند. نشان داده شده است که حاشیه برداشت منفی به طور مداوم با کاهش خطر پیامدهای نامطلوب (عود، کارسینوم باقیمانده، متاستاز غدد لنفاوی و کاهش بقا) همراه است. بیست و هفت درصد از بیماران با حاشیههای تومور مثبت یا نامشخص، پیامدهای نامطلوبی خواهند داشت، در مقایسه با ۱۸٪ با حاشیههای منفی و ویژگیهای پیشآگهی ضعیف و ۰.۸٪ با حاشیههای منفی و بدون هیچ ویژگی پیشآگهی ضعیف دیگر. بنابراین، عوامل خطر متعدد باید با هم ارزیابی شوند.
| جدول 12.6 طبقهبندی هاگیت برای سرطانهای کولورکتال ناشی از آدنومها |
 |
پولیپکتومی کولونوسکوپی برای برداشتن تقریباً تمام پولیپهای پایهدار ایمن و مؤثر است. برای پولیپهایی که قابل پولیپکتومی نیستند، میتوان از رزکسیون مخاطی آندوسکوپی (EMR) استفاده کرد و به ویژه در برداشتن ضایعات کوچک (نه بیشتر از 1 سانتیمتر)، مسطح یا فرورفته مفید است. EMR منجر به برداشتن کامل ضایعه و لایه زیرمخاطی عمیق میشود و اطلاعات پاتولوژیک بیشتری را ارائه میدهد. علاوه بر این، EMR به تنهایی ممکن است برای سرطانهای اولیه بدون ویژگیهای تهاجمی، درمان کافی باشد. رزکسیون جراحی برای ضایعات بزرگ و بدون پایه پرز توصیه میشود.
ضایعات قارچی، زخمی یا تغییر شکل یافته که دیواره روده اطراف را تخریب میکنند، نشان دهنده وجود سرطان تهاجمی هستند و منع مصرف پولیپکتومی دارند. رزکسیون جراحی همچنین برای بیمارانی که کارسینوم تهاجمی باقیمانده دارند و برای افرادی که با وجود پولیپکتومی کامل آندوسکوپی در معرض خطر بالای متاستاز غدد لنفاوی هستند، توصیه میشود. علامتگذاری محل پولیپ یا پولیپکتومی، معمولاً به شکل خالکوبی، باید در زمان کولونوسکوپی یا ظرف ۲ هفته انجام شود تا دقت تشخیص ضایعه هدف در زمان برداشتن جراحی بهبود یابد.
ویژگیهای پاتولوژیک پرخطر که قبلاً شرح داده شده است (حاشیه ≤۲ میلیمتر، تمایز ضعیف، سطح هاگیت ۴، و تهاجم عروقی و/یا لنفاوی) و افزایش خطر مرتبط با متاستاز غدد لنفاوی باید در برابر خطر برداشتن جراحی سنجیده شود. در بررسی ۱۷ مطالعه برای ارزیابی فراوانی متاستاز غدد لنفاوی یا کارسینوم باقیمانده در بیماران کمخطر با پولیپهای پایهدار، تنها ۱٪ بروز مشاهده شد. در پولیپهای بیپایه با ویژگیهای کمخطر، میزان بروز به ۴.۱٪ افزایش یافت. از آنجا که میزان بروز متاستازهای گرهای در پولیپهای بیپایه با سرطان مهاجم بیشتر است، بیمارانی که در معرض خطر کم عمل جراحی هستند، حتی اگر هیچ ویژگی پاتولوژیک پرخطری مشاهده نشود، ممکن است برای برداشتن در نظر گرفته شوند. تهاجم ساقه در پولیپهای پایهدار یک ویژگی بافتشناسی نامطلوب محسوب نمیشود و درمان پولیپهایی با تهاجم ساقه مانند پولیپهایی بدون تهاجم ساقه است (بر اساس طبقهبندی خطر). آدنومهای پرزدار بزرگ رکتوم ممکن است با برداشتن موضعی ترانسآنال قابل انجام باشند. این یک ارزیابی تشخیصی کامل برای بدخیمی فراهم میکند و اگر با حاشیههای منفی برداشته شود (با سایر ویژگیهای پیشآگهی مطلوب)، ممکن است تنها روش درمانی مورد نیاز باشد.
بیماری التهابی روده
کولیت اولسراتیو مزمن خطر ابتلا به سرطان روده بزرگ را 30 برابر بیشتر از جمعیت عمومی دارد. به طور مشابه، کولیت کرون طولانیمدت با خطر سرطان روده بزرگ به طور قابل توجهی بالاتر همراه است. خطر ابتلا به سرطان در بیماری التهابی روده، ۸ سال پس از شروع پان کولیت و ۱۲ تا ۱۵ سال پس از کولیت سمت چپ به طور قابل توجهی افزایش مییابد. این خطر پس از ۱۰ سال، سالانه ۰.۵ تا ۱ درصد افزایش مییابد و در ۳۰ سالگی به ۱۸ تا ۳۵ درصد میرسد. شدت، وسعت و مدت التهاب، و همچنین سابقه خانوادگی سرطان روده بزرگ (CRC) و سابقه کلانژیت اسکلروزان اولیه، از عوامل خطر ابتلا به سرطان هستند. برخلاف سرطانهای روده بزرگ پراکنده، این سرطانها اغلب متعدد، با نفوذ گسترده و تمایز ضعیف هستند. شناسایی آنها به دلیل التهاب مزمن و جای زخم، و همچنین این واقعیت که بسیاری از آنها از ضایعات یا تودههای مرتبط با دیسپلازی (DALM) ناشی میشوند که اغلب ضایعات مسطحی هستند که به راحتی در طول آندوسکوپی قابل تشخیص نیستند، میتواند بسیار دشوار باشد. کولونوسکوپی نظارتی هر ۱ تا ۲ سال با بیوپسیهای تصادفی ۴ ربعی هر ۱۰ سانتیمتر در سراسر ناحیه آسیبدیده توصیه میشود. حداقل ۳۳ بیوپسی برای بیماران مبتلا به بیماری گسترده توصیه میشود. در بیماران مبتلا به کولیت اولسراتیو، باید بیوپسی هر ۵ سانتیمتر در سیگموئید دیستال و رکتوم که خطر سرطان در آنها بالاترین است، در نظر گرفته شود. کولکتومی یا پروکتوکولکتومی برای بیمارانی که شواهدی از دیسپلازی درجه بالا دارند توصیه میشود و حتی برای افرادی که شواهدی از دیسپلازی درجه پایین دارند نیز باید در نظر گرفته شود.


بدون دیدگاه