سرطان مثانه
اپیدمیولوژی و علت شناسی
سرطان مثانه دومین بدخیمی شایع دستگاه ادراری تناسلی در ایالات متحده است. این سرطان چهارمین سرطان شایع در مردان و دهمین سرطان شایع در زنان است. در سال ۲۰۱۶، تقریباً ۷۶۹۶۰ مورد جدید مورد انتظار بود و ۱۶۳۹۰ مرگ تخمینی به سرطان مثانه نسبت داده شد. احتمال ابتلا به سرطان مثانه در طول عمر در مردان ۱ در ۲۶ و در زنان ۱ در ۸۸ است و برای آمریکاییهای آفریقاییتبار در مقایسه با سفیدپوستان کمتر است.
علت شناسی سرطان مثانه، که کارسینوم اوروتلیال (یا سلول انتقالی) شایعترین آن است، به خوبی مشخص شده است. سیگار کشیدن با ۳۰ تا ۴۰ درصد از کل موارد سرطان مثانه مرتبط دانسته شده است. نشان داده شده است که مواد شیمیایی ۱-نفتیلامین، ۲-نفتیلامین، بنزیدین و ۴-آمینو بی فنیل باعث سرطانزایی اوروتلیال میشوند. کارگران صنایع نساجی، چرم، پالایش آلومینیوم، لاستیک و مواد شیمیایی که در معرض سطوح بالای این مواد شیمیایی قرار دارند، میزان ابتلا به سرطان مثانه در آنها افزایش مییابد. سایر مواد شیمیایی که با سرطان اوروتلیال مرتبط دانسته شدهاند عبارتند از MBUCCA (صنعت پلاستیک)، فناستین و عامل ضد نئوپلاستیک سیکلوفسفامید. علاوه بر این، عفونتهای مکرر مثانه و همچنین عفونتهای ناشی از انگل شیستوزوما هماتوبیوم با کارسینوم سلول سنگفرشی مثانه مرتبط بودهاند.
پاتولوژی
مثانه ادراری یک احشاء توخالی است که هم در ذخیره و هم در تخلیه ادرار نقش دارد. از نظر بافتشناسی، مثانه از مخاط، لایه داخلی مثانه، لایه عضلانی مثانه و سروز (محدود به گنبد) تشکیل شده است. سرطان مثانه موضعی به عنوان سرطان مثانه غیرتهاجمی به عضله (NMIBC) طبقهبندی میشود که محدود به مخاط و لایه داخلی مثانه است، یا بیماری تهاجمی به عضله (MIBC) که به لایه داخلی مثانه و فراتر از آن گسترش مییابد. تقریباً 70٪ از سرطانهای مثانه تازه تشخیص داده شده از نوع NMIBC هستند، در حالی که 30٪ باقی مانده تهاجمی هستند.
هنگامی که سرطان مثانه از لایه پایه مخاط عبور میکند، ممکن است به رگهای خونی و لنفاوی حمله کند و در نتیجه مسیری برای متاستاز فراهم کند. کارسینوم درجا (CIS)، یک شکل تهاجمی از NMIBC، از کارسینوم یوروتلیال مسطح و درجه بالا تشکیل شده است که محدود به لایه مخاطی است.
سازمان بهداشت جهانی (WHO) تومورهای اپیتلیال مثانه را به چهار نوع بافتشناسی طبقهبندی میکند: کارسینوم یوروتلیال (91٪)، کارسینوم سلول سنگفرشی (7٪)، آدنوکارسینوم (2٪) و سایر انواع کارسینوم یوروتلیال (کمتر از 1٪). با این حال، تا 20٪ از کارسینومهای یوروتلیال حاوی نواحی تمایز سنگفرشی و تا 7٪ حاوی نواحی تمایز آدنوماتوز هستند. در ادامه این بخش به کارسینومهای یوروتلیال پرداخته میشود.
تظاهرات بالینی
هشتاد درصد از کل بیمارانی که با سرطان مثانه مراجعه میکنند، دارای هماچوری آشکار یا میکروسکوپی هستند که معمولاً بدون درد و متناوب است. تقریباً 20٪ از بیماران از علائم تحریکی ادرار، از جمله تکرر ادرار، فوریت در دفع ادرار، سوزش ادرار و استرانگوریا، به ویژه در CIS، شکایت دارند. علائم دیگر شامل درد لگن، درد پهلو (ناشی از انسداد حالب) و ادم اندام تحتانی است. بیماران مبتلا به بیماری سیستمیک ممکن است با کمخونی، کاهش وزن و درد استخوانی مراجعه کنند.
تشخیص
بیماری که با هماچوری یا سایر علائم سرطان مثانه مراجعه میکند، باید تحت ارزیابی کامل اورولوژی شامل شرح حال، معاینه فیزیکی، آزمایش ادرار، بررسی سیستوسکوپی مثانه، ادرار دفع شده برای بررسی سیتولوژیک و سیتیاسکن داخل وریدی با ماده حاجب از شکم و لگن قرار گیرد. مفیدترین این مراحل، معاینه بصری مستقیم مثانه با استفاده از سیستوسکوپ انعطافپذیر در مطب است. تومورهای پاپیلاری و بیپایه به راحتی از طریق سیستوسکوپ قابل مشاهده هستند. با این حال، CIS میتواند به صورت مخاط طبیعی یا به صورت لکههای قرمز در سراسر مثانه ظاهر شود. ارزیابی آندوسکوپی به طور سنتی از سیستوسکوپی با نور سفید استفاده کرده است، اما اخیراً سیستوسکوپی با نور آبی با تزریق داخل مثانهای هگزامینولولینات به عنوان یک روش کمکی با افزایش میزان تشخیص سرطان مثانه، به ویژه برای CIS، ظهور کرده است. کمتر از ۶۰٪ تومورهای مثانه را میتوان در سیتیاسکن مشاهده کرد، اما این معاینه در درجه اول برای شناسایی سایر ناهنجاریهایی که ممکن است در دستگاه ادراری فوقانی وجود داشته باشند (لگنچه کلیه یا تومورهای حالب، هیدرونفروز مرتبط و غیره) علاوه بر ارزیابی تومور اولیه مثانه، وجود گسترش موضعی به بافتهای نرم و وجود لنفادنوپاتی منطقهای انجام میشود. سیتولوژی ادرار در حدود ۳۰٪ از بیماران مبتلا به تومورهای درجه پایین و ۶۵٪ تا ۱۰۰٪ از بیماران مبتلا به تومورهای درجه بالا یا CIS مثبت گزارش شده است (برای تعریف درجهها به بخش بعدی مراجعه کنید).
درجهبندی و مرحلهبندی
سیستم درجهبندی WHO که در سال ۲۰۰۴ بهروزرسانی شد، بر اساس ویژگیهای سیتولوژیک تومور است. تومورهای درجه پایین به خوبی تمایز یافته و تومورهای درجه بالا به طور ضعیف تمایز یافته هستند.
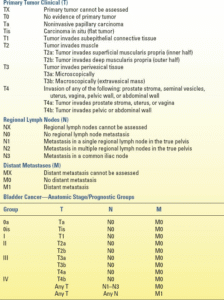
پس از تشخیص تومور مثانه، متخصص اورولوژی باید تومور را به طور دقیق مرحلهبندی کند. برداشتن اولیه تومور مثانه از طریق مجرای ادرار (TURBT)، که معمولاً همراه با بیوپسیهای تصادفی از مثانه و مجرای ادرار پروستات انجام میشود، عمق بافتشناسی تهاجم تومور و وجود یا عدم وجود دیسپلازی یا CIS را تعیین میکند. در زمان برداشتن تومور، باید معاینه دو دستی انجام شود تا مشخص شود که آیا تودهای وجود دارد یا خیر و در صورت وجود، آیا ثابت است یا متحرک. بررسیهای بیشتر برای تشخیص متاستاز شامل سیتیاسکن، آزمایشهای عملکرد کبد، رادیوگرافی قفسه سینه و اسکن استخوان (در صورت بالا بودن سطح آلکالین فسفاتاز یا وجود علائم بیمار، بیماری سیستمیک) است. سیستمهای مرحلهبندی TNM کمیته مشترک سرطان آمریکا در جدول 19.3 فهرست شدهاند.
| جدول19.3 سیستمهای مرحلهبندی سرطان مثانه |
 |
مدیریت
سرطان مثانه غیرتهاجمی به عضله
تقریباً 70٪ از سرطانهای مثانه به صورت NMIBC (مثلاً Ta، T1 یا Tis) بروز میکنند. تخمین زده میشود که 70٪ از این سرطانها Ta و 20٪ T1 هستند. ده درصد از کل سرطانهای مثانه با Ti یا CIS بروز میکنند. پس از درمان اولیه NMIBC، بیماری قابل درمان است، میتواند با همان مرحله و درجه عود کند، یا میتواند با پیشرفت مرحله یا درجه عود کند. عوامل خطر مرتبط با عود و پیشرفت بیماری شامل درجه بالای تومور، تهاجم به لامینا پروپریا، قطر تومور بزرگتر از 3 سانتیمتر، تهاجم عروقی یا لنفاوی، چندگانگی و بیان فاکتور رشد اپیدرمی یا فاکتور رشد تغییر شکل دهنده آلفا است. جهش در TP53 نیز ممکن است با خطر قابل توجهی از پیشرفت بیماری همراه باشد. درمان اولیه NMIBC بر ریشهکنی بیماری موجود با استفاده از برداشتن تومور مثانه از طریق مجرای ادرار (TURBT) و پیشگیری شیمیایی در برابر عود یا پیشرفت بیماری تمرکز دارد. TURBT درمان استاندارد برای تومورهای موجود در مرحله Ta و T1 و تومورهای قابل مشاهده در مرحله Tis بوده است.
لیزر درمانی یکی دیگر از گزینههای درمانی است که منجر به عوارض خونریزی کمتری میشود. مزیت برداشتن تومور از طریق مجرای ادرار نسبت به لیزر درمانی این است که بافتی را برای معاینه بافتشناسی فراهم میکند. بیمارانی که در زمان TURBT ظاهراً NMIBC دارند، در صورت عدم وجود سوراخ شدن مثانه، باید ظرف 6 ساعت پس از برداشتن تومور، یک دوز میتومایسین C داخل مثانه دریافت کنند. نشان داده شده است که این دوز واحد خطر عود سرطان مثانه را حدود 40٪ کاهش میدهد. بیمارانی که بیماری T1 دارند باید 2 تا 6 هفته پس از TURBT اولیه، TURBT مجدد انجام دهند، زیرا این بیماران 30٪ خطر ابتلا به بیماری T2 یا بالاتر را دارند. بیماران مبتلا به NMIBC با خطر بالای عود و پیشرفت بیماری – از جمله بیماران مبتلا به CIS، ضایعات Ta یا T1 با درجه بالا، تومورهای چند کانونی و عودکننده و به ندرت بیماری باقیمانده – ممکن است کاندید درمان داخل مثانهای کمکی باشند. عوامل داخل مثانهای میتوانند به عنوان درمان درمانی، کمکی یا پیشگیریکننده برای سرطان مثانه استفاده شوند. تیوتپا، میتومایسین C، جمسیتابین و والروبیسین عوامل شیمیدرمانی هستند که بیشتر مورد استفاده قرار میگیرند.
باسیلوس کالمت – گرن (BCG)، یک ارگانیسم زنده ضعیف شده سل، به پرکاربردترین عامل داخل مثانهای در NMIBC تبدیل شده است، که معمولاً به تنهایی و کمتر در ترکیب با آلفا-اینترفرون استفاده میشود. BCG پاسخ ایمنی خود بیمار را در برابر تومور افزایش میدهد و در نتیجه مقاومت در برابر عود بیماری را ایجاد میکند و در نتیجه به طور بالقوه پیشرفت را به تأخیر میاندازد. BCG معمولاً 4 تا 6 هفته پس از TURBT شروع میشود، زیرا شروع BCG خیلی زود پس از TURBT (قبل از بهبودی اوروتلیال) ممکن است منجر به سپسیس BCG شود.
اگرچه برنامهریزی دوز خاص متفاوت است، اما اکثر رژیمهای درمانی شامل درمان داخل مثانهای هفتگی به مدت 6 هفته و به دنبال آن مجموعهای از درمانهای نگهدارنده طی 12 تا 36 ماه است. نشان داده شده است که BCG در 80٪ از بیماران در یک پیگیری 5 ساله، CIS را از بین میبرد، میزان عود تومور را برای بیماران مبتلا به بیماری T1 در 4 سال به 30٪ کاهش میدهد و تومور باقیمانده را در تا 59٪ از بیماران از بین میبرد. به نظر میرسد رژیمهای درمانی نگهدارنده با BCG بهترین نتایج را برای بیماران ارائه میدهند. در سال 2000، لام و همکارانش 384 بیمار مبتلا به NMIBC را به صورت تصادفی برای دریافت BCG القایی و نگهدارنده یا درمان القایی BCG به تنهایی انتخاب کردند. میانگین زمان بقای بدون عود برای کسانی که درمان القایی و نگهدارنده دریافت کردند، طولانیتر بود. با این حال، در پیگیری 5 ساله هیچ تفاوتی در بقا وجود نداشت. در سال ۲۰۰۲، سیلوستر و همکارانش یک متاآنالیز از ۲۴ کارآزمایی بالینی انجام دادند و دریافتند که تنها بیمارانی که پس از TURBT تحت درمان نگهدارنده با BCG قرار گرفتند، خطر کمتری برای پیشرفت به بیماری تهاجمی عضلانی داشتند.
شواهد خوبی وجود دارد که نشان میدهد سرطان مثانه درجه بالای T1 میزان پیشرفت بالایی دارد و بنابراین خطر مرگ بالایی را به همراه دارد. بنابراین، ما سیستکتومی رادیکال اولیه (قبل از ایجاد تهاجم عضلانی) را برای بیماران منتخب مبتلا به سرطان مثانه درجه بالای T1 توصیه میکنیم. علاوه بر این، ما سیستکتومی را برای بیمارانی که علیرغم دو دوره القایی درمان BCG یا درمان نگهدارنده با BCG، بیماری آنها در عرض ۱ سال عود میکند نیز توصیه میکنیم، زیرا نشان داده شده است که این بیماران در صورت باقی ماندن مثانه در محل خود، در معرض خطر بالای پیشرفت بیماری هستند.
سرطان مثانه تهاجمی
تومورهایی که به لایه عضلانی پروپریا نفوذ کردهاند، تهاجمی در نظر گرفته میشوند. چندین گزینه برای درمان بیماران مبتلا به تومورهای تهاجمی در دسترس است. زیرمجموعه کوچکی از بیماران ممکن است واجد شرایط درمان با حفظ مثانه باشند. در سال ۲۰۰۱، Herr میزان بقای کلی ۷۶٪ را نشان داد، که ۵۷٪ از بیماران در ۴۵ بیمار تحت درمان با رزکسیون تهاجمی تومورهای مهاجم مثانه از طریق مجرای ادرار، مثانه خود را حفظ کردند (میانگین پیگیری: ۶۱ ماه). بیمارانی که MIBC اولیه و منفرد دارند، CIS مرتبط ندارند، معمولاً در گنبد مثانه و اجازه میدهند حاشیه جراحی ۲ سانتیمتری وجود داشته باشد، ممکن است کاندیدای سیستکتومی جزئی باشند.
در مرکز سرطان ام دی اندرسون، دادهها نشان دادهاند که تقریباً ۵٪ از بیماران در واقع برای جراحی حفظ مثانه مناسب هستند؛ میزان بقای ۵ ساله با میزان بقای حاصل از سیستکتومی رادیکال، زمانی که میتوان حاشیههای منفی رزکسیون را به دست آورد، قابل مقایسه بوده است.
EBRT اولیه برای درمان MIBC استفاده شده است. پروتکلهای درمانی دوزهای 65 تا 70 گری را توصیه میکنند. میزان بقای پنج ساله برای سرطان مثانه T2 از 21٪ تا 52٪ و برای تومورهای T3 از 18٪ تا 30٪ متغیر است. عود موضعی در 50٪ تا 70٪ از این بیماران رخ میدهد. ضایعات T4 بدتر میشوند و میزان بقای 5 ساله به طور مداوم کمتر از 10٪ است. تجربه ما در مرکز سرطان MD Anderson نشان داد که میزان بقای 5 ساله با تابش اولیه پرتو خارجی 26٪ است. بنابراین، EBRT ممکن است در بیمارانی که نمیخواهند جراحی شوند یا جراحی رادیکال برای آنها منع پزشکی دارد، مفید باشد. با این حال، نتایج پرتودرمانی، مرحله به مرحله، به طور قابل توجهی بدتر از نتایج مشاهده شده با جراحی رادیکال است. EBRT به تنهایی نیز نسبت به EBRT با شیمی درمانی همزمان پس از TURBT برای MIBC ضعیفتر است.
در تلاشی برای بهبود میزان بقا و حفظ مثانه، استراتژیهای چندوجهی TURBT، شیمی درمانی و پرتودرمانی را با هم ترکیب کردهاند. در سال ۱۹۹۷، کاچنیک و همکارانش از بیمارستان عمومی ماساچوست، گزارشی از ۱۰۶ بیمار مبتلا به سرطان مثانه T2 تا T4 ارائه دادند که با TURBT، دو دوره متوترکسات، سیس پلاتین، وینبلاستین (MCV) و پرتودرمانی ۴۰ گری به همراه سیس پلاتین همزمان درمان شده بودند. میزان بقای کلی ۵ ساله ۵۲٪ و میزان بقای کلی ۵ ساله با مثانه سالم ۴۳٪ بود. این نتایج با سری سیستکتومی رادیکال معاصر قابل مقایسه است.
با این حال، این رژیم شامل عوارض قابل توجه و سرمایهگذاری بیمار در برنامههای درمانی پیچیده است. علاوه بر این، بیماران در معرض خطر قابل توجهی از سیستکتومی نهایی و عود سرطان مثانه سطحی قرار دارند. سیستکتومی رادیکال با لنفادنکتومی لگنی با هدف از بین بردن تمام بیماریهای لنفاوی موضعی و منطقهای انجام میشود. شواهدی وجود دارد که نشان میدهد لنفادنکتومی لگنی گسترده (با شروع از جمجمه از شریان مزانتریک تحتانی) تشخیص متاستاز غدد لنفاوی را بهبود میبخشد و میتواند به ویژه در بیمارانی که بیماری غدد لنفاوی حداقلی دارند، یک مزیت درمانی داشته باشد. در سال ۲۰۰۱، استین و همکارانش در مورد ۱۰۵۴ بیماری که با سیستکتومی رادیکال باز و لنفادنکتومی لگنی در یک موسسه واحد درمان شده بودند، گزارش دادند. میزان مرگ و میر در حین عمل ۲.۵٪ بود و ۲۸٪ عوارض اولیه پس از عمل را تجربه کردند. بقای ده ساله بدون عود در بیماران با غدد لنفاوی منفی برای pT0، ۸۶٪، برای pTcis، ۸۹٪، برای pTa، ۷۸٪، برای pT1، ۸۷٪، برای pT2، ۷۶٪، برای pT3a، ۶۱٪ و برای pT3b، ۴۵٪ بود. بیست و چهار درصد از کل بیماران غدد لنفاوی مثبت داشتند و بقای ده ساله بدون عود آنها ۳۴٪ بود. میانگین زمان عود در این گروه از بیماران ۱۲ ماه بود (۲۲٪ از بیماران عود دوردست و ۷٪ عود موضعی لگن داشتند). در دهه گذشته، چندین مرکز استفاده از سیستکتومی رادیکال لاپاروسکوپی و لاپاروسکوپی با کمک ربات را با انحراف ادراری خارج از بدن یا داخل بدن آغاز کردهاند. با این حال، به دلیل پیگیری نسبتاً کوتاه، هنوز نمیتوان اثربخشی انکولوژیک طولانی مدت این روشها را ارزیابی کرد.
هنگامی که بیمار تحت سیستکتومی قرار میگیرد، حالبها باید به یک سیستم تخلیه جایگزین هدایت شوند. رایجترین انحرافات ادراری که امروزه استفاده میشوند، یا یک مجرای ایلئوم (انحراف بیاختیاری) یا یک انحراف ادراری ارتوتوپیک با یک بخش ایلئوم (انحراف کانتیننت) هستند. بیمارانی که قادر به انجام انحراف ارتوتوپیک نیستند، شامل بیمارانی با کراتینین سرم بالا، شواهدی از متاستاز غدد لنفاوی، کارسینوم اوروتلیال تهاجمی پروستات به مجرای ادرار یا CIS، بیماری التهابی روده یا بیماری تنگی شدید مجرای ادرار در بیماران مرد هستند. علاوه بر این، این بیماران باید مایل و قادر به انجام یک برنامه بازآموزی ادرار شدید باشند. پرتودرمانی ممکن است کنترل ادرار را دشوار کند؛ بنابراین، برخی از بیماران ممکن است از این نوع انحراف ادرار بهرهمند نشوند.
مخازن پوستی قابل کاتتریزاسیون مانند کیسه ایندیانا نیز به عنوان روشهایی برای انحراف ادرار با کنترل ادرار در بیماران منتخب استفاده میشوند. در نهایت، اگر بیماری قادر به برآورده کردن این معیارها نباشد، انحراف غیر کنترل ادرار با مجرای ایلئوم پوستی توصیه میشود.
گروسمن و همکارانش یک کارآزمایی تصادفی فاز 3 را از طریق SWOG انجام دادند که سیستکتومی رادیکال به تنهایی را با شیمیدرمانی نئوادجوانت مقایسه میکرد و به دنبال آن سیستکتومی رادیکال انجام شد و 5٪ افزایش بقای کلی با رویکرد دوم گزارش شد. در مرکز سرطان MD Anderson، شیمیدرمانی کمکی برای بیماران منتخب با ویژگیهای نامطلوب بیماری، از جمله متاستازهای غدد لنفاوی برداشته شده، درگیری گسترده خارج مثانهای یا درگیری احشاء لگنی، استفاده میشود. پیش از این، درمان با شیمیدرمانی کمکی در بیماران منتخب در مرکز سرطان MD Anderson منجر به نرخ بقای 5 ساله 70 درصدی شده بود که با بیمارانی که علائم نامطلوب نداشتند قابل مقایسه است. در حال حاضر، چندین درمان هدفمند در شرایط نئوادجوانت و متاستاتیک در حال بررسی هستند.
بیماری متاستاتیک
به نظر میرسد سیس پلاتین عاملی است که بیشترین فعالیت را علیه کارسینوم اوروتلیال مثانه دارد؛ با این حال، میزان پاسخ به درمان تک عاملی تنها در محدوده 10 تا 30 درصد است. به طور سنتی، شیمی درمانی برای سرطان مثانه شامل سیس پلاتین، متوترکسات، وینبلاستین و دوکسوروبیسین (M-VAC) بود. در آزمایش مرکز سرطان MD Anderson روی M-VAC، میزان پاسخ کامل 35٪ و میزان پاسخ جزئی 30٪ مشاهده شد. سایر آزمایشها میزان پاسخ مشابهی را با میانگین بقای تقریباً 1 سال ثبت کردهاند. رژیمهای جدیدتر با استفاده از جمسیتابین و سیس پلاتین هیچ تفاوت معنیداری در بقا در مقایسه با M-VAC نشان ندادهاند، اما عوارض جانبی نامطلوب و سمیت با رژیم جدیدتر که اکنون بیشتر در این شرایط استفاده میشود، کاهش مییابد.
سرطان کلیه
اپیدمیولوژی و علتشناسی
تومورهای بافتهای کلیوی و اطراف کلیه 3٪ از بروز و مرگ و میر سرطان در ایالات متحده را تشکیل میدهند. کارسینوم سلول کلیوی (RCC)
85٪ از کل تومورهای پارانشیم کلیه را تشکیل میدهد و تنها تومور کلیوی است که در این فصل مورد بحث قرار گرفته است. در سال ۲۰۱۶، تخمین زده شد که ۶۲۷۰۰ نفر به بدخیمیهای کلیه و لگنچه کلیه مبتلا شدهاند و نزدیک به ۱۴۴۲۰ نفر بر اثر این بیماری جان خود را از دست دادهاند. از سال ۱۹۷۵ تا ۱۹۹۵، میزان بروز و مرگ و میر ناشی از RCC افزایش یافته است. روند صعودی میزان مرگ و میر نشان میدهد که افزایش تشخیص تصادفی تومورهای بدون علامت در مراحل اولیه، به طور کامل افزایش کلی بروز را توجیه نمیکند. این افزایش بروز در آمریکاییهای آفریقاییتبار به طور قابل توجهی بیشتر دیده میشود. مردان دو برابر زنان به آن مبتلا میشوند. RCC اغلب در دهههای پنجم تا ششم زندگی رخ میدهد. چندین عامل خطر مرتبط با RCC شناسایی شدهاند. مطالعات مورد-شاهدی، همبستگی قوی با سیگار کشیدن و چاقی را نشان دادهاند. فشار خون بالا، دیابت شیرین، مواجهه شغلی (از جمله کادمیوم، آزبست و بنزین) و استفاده از داروهای ادرارآور نیز با RCC مرتبط بودهاند. با این حال، مشخص نیست که آیا این یک رابطه علیتی است یا خیر. RCC میتواند به صورت پراکنده یا ژنتیکی رخ دهد. RCC ارثی معمولاً در سنین پایینتر شروع میشود و معمولاً دو طرفه و چند کانونی است. یک سندرم خانوادگی شناخته شده، بیماری فون هیپل-لینداو (VHL) است که با همانژیوبلاستومای مخچه، آنژیومای شبکیه، RCC سلول شفاف دو طرفه و تومورهای سلول جزیرهای پانکراس مشخص میشود. هر دو نوع بیماری پراکنده و VHL یک مکانیسم ژنتیکی مشترک دارند که شامل از دست دادن ناحیهای از کروموزوم 3p است. اعتقاد بر این است که اکثر RCC های سلول شفاف، ژن VHL را از طریق جهش، حذف یا خاموش شدن توسط متیلاسیون از دست میدهند. RCC پاپیلاری ارثی (نوع پاپیلاری ۱) یک سندرم اتوزومال غالب است که با ناهنجاریهای ژن MET روی کروموزوم ۷ مرتبط است. سایر سندرمهای ژنتیکی RCC شامل لیومیوماتوز ارثی و RCC (نوع پاپیلاری ۲) است که با جهش در آنزیم فومارات هیدراتاز چرخه کربس مرتبط است و سندرم Birt-Hogg-Dubé که به صورت تومورهای چند کانونی دو طرفه با RCC کروموفوب و بافتشناسی انکوسیتوم بروز میکند. RCC همچنین با بیماری کلیه پلی کیستیک، توبروس اسکلروز و بیماری کیستیک کلیوی اکتسابی مرتبط است.
آسیب شناسی
بافتشناسی سلول شفاف شایعترین زیرگروه RCC است. اکثر RCCها از سلولهای توبولی پروگزیمال کلیه منشأ میگیرند. تومور در ۶.۵٪ تا ۱۰٪ موارد چند کانونی است که بیشتر با بافتشناسی پاپیلاری همراه است. کپسول کلیوی و فاسیای ژروتا که کلیه را احاطه کرده است، معمولاً گسترش موضعی تومور را محدود میکنند. سلولهای تومور معمولاً غنی از گلیکوژن و لیپید هستند و به تومور ظاهری شفاف سلولی (از نظر میکروسکوپی) و ظاهری زرد رنگ مشخص در نمای خارجی میدهند.
پاتولوژیهای کمتر شایع شامل RCC پاپیلاری و کروموفوب هستند. RCC طبقهبندی نشده، یک طبقهبندی بیاهمیت برای تومورهایی است که با معیارهای بافتشناسیهای کلاسیک مطابقت ندارند. تمایززدایی سارکوماتوئید، که زمانی تصور میشد یک طبقهبندی بافتشناسی جداگانه است، اکنون به عنوان یک مسیر تمایززدایی شناخته میشود که میتواند با هر بافتشناسی RCC، از جمله سلول شفاف، پاپیلاری و کروموفوب، رخ دهد. انکوسیتوم یک تومور خوشخیم بدون پتانسیل بدخیمی است که تمایز آن از RCC کروموفوب در بیوپسی سوزنی میتواند مشکلساز باشد: هر دو در مجموع به عنوان نئوپلاسمهای انکوسیتیک شناخته میشوند، زمانی که تشخیص قطعی در نمونه بیوپسی امکانپذیر نباشد.
تظاهرات بالینی
RCC به دلیل تظاهرات نامحسوس خود، به طور سنتی “تومور متخصص داخلی” نامیده میشد. اکنون بیش از 40٪ از تومورهایی که از نظر بالینی مشکوک نیستند، به طور تصادفی در تصویربرداری شکمی که به دلایل دیگر انجام میشود، یافت میشوند. هماچوری آشکار یا میکروسکوپی، شایعترین علامت ظاهری، در برخی از بیماران مبتلا به RCC وجود دارد. سهگانه کلاسیک “خیلی دیر” شامل هماچوری، توده شکمی و درد پهلو اکنون کمتر دیده میشود. سندرمهای پارانئوپلاستیک در 10 تا 40 درصد موارد رخ میدهند و شامل تب، کمخونی، اریتروسیتوز، هیپرکلسمی، اختلال عملکرد کبد (سندرم استافر) و فشار خون بالا هستند. سایر علائم شایع شامل درد استخوان و ناهنجاریهای سیستم عصبی مرکزی، به دلیل متاستاز استخوان و مغز است. خطر متاستاز در زمان مراجعه و خطر تبدیل توده کلیوی به RCC در زمان مراجعه، ارتباط قوی با اندازه تومور دارد.
تشخیص
بررسی بیماری که علائم قبلی را دارد باید شامل “شرح حال، معاینه فیزیکی، شمارش کامل سلولهای خون، آزمایشهای شیمیایی سرم (شامل آلکالین فسفاتاز و آزمایشهای عملکرد کبد)، آزمایش ادرار، کشت ادرار، عکس قفسه سینه و سیتیاسکن شکم با ماده حاجب باشد. در بیشتر موارد، سیتیاسکن ماهیت توده را مشخص میکند. اگر هر یک از مطالعات انجام شده نشان دهنده درگیری ترومبوز تومور در ورید کلیوی یا ورید اجوف باشد، باید MRI یا سیتیاسکن با بازسازی سهبعدی برای ارزیابی وسعت ترومبوز تومور انجام شود. برخلاف مدیریت سایر تومورهای کلیوی، RCC را میتوان بدون تشخیص بافتشناسی تومور قبل از عمل، با جراحی درمان کرد. نقش بیوپسی توده کلیوی برای بیمارانی که کاندید جراحی هستند و تومورهای موضعی قابل برداشت دارند، ممکن است محدود باشد، مگر اینکه ویژگیهای رادیوگرافی توده، علتی غیر از RCC، مانند آبسه، لنفوم، کارسینوم اوروتلیال یا متاستاز از یک تومور بدخیم اولیه دیگر را نشان دهد. دستورالعملها اکیداً بیوپسی توده کلیوی را قبل از درمان ابلیشن یا نظارت فعال برای RCC موضعی یا درمان سیستمیک (بدون هیستوپاتولوژی قبلی) برای بیماری پیشرفته یا متاستاتیک توصیه میکنند.
اگر تودهای RCC را نشان دهد، باید یک بررسی متاستاتیک شامل رادیوگرافی قفسه سینه، سیتیاسکن (اگر قبلاً گرفته نشده باشد) و آزمایشهای عملکرد کبد انجام شود. شایعترین محلهای متاستاز RCC به ترتیب کاهشی، ریه، استخوان و غدد لنفاوی منطقهای هستند. اگر بیمار افزایش سطح آلکالین فسفاتاز یا درد اسکلتی نداشته باشد، معمولاً اسکن استخوان لازم نیست. در صورت وجود هرگونه سوءظن به متاستازهای مغزی، میتوان اسکن MRI مغز انجام داد و باید در بیمارانی که بیماری متاستاتیک در جای دیگری دارند، انجام شود.
درجهبندی و مرحلهبندی
پرکاربردترین سیستم درجهبندی برای RCC، سیستم فورمن است که بر اساس مورفولوژی هستهای و هستکی بوده و در مقیاس ۱ تا ۴ رتبهبندی میشود.
| جدول19.4 سیستمهای مرحلهبندی سرطان سلول کلیوی |
 |
سیستم TNM بیشتر برای مرحلهبندی در ایالات متحده استفاده میشود (به جدول 19.4 مراجعه کنید).
مدیریت
سرطان سلول کلیوی موضعی/پیشرفته موضعی
تا به امروز، برداشتن جراحی تنها درمان مؤثر اثباتشده RCC موضعی است. موقعیتهایی وجود دارد که در صورت امکان، جراحی حفظ نفرون برای بیماران مبتلا به RCC توصیه میشود. به عنوان مثال، در موارد تومورهای cT1a، نفرکتومی جزئی، استاندارد مراقبت و یک استاندارد جایگزین برای تودههای کلیوی cT1b است، به ویژه هنگامی که نیاز به حفظ پارانشیم کلیه وجود دارد. همچنین نفرکتومی جزئی برای درگیری دو طرفه تومور، نارسایی کلیه، کلیه منفرد و RCC ارثی مانند VHL توصیه میشود. در این روش، شریان کلیوی به طور موقت مسدود میشود، کلیه خنک میشود و نفرکتومی جزئی یا برداشتن گوهای انجام میشود.
ارزیابی کلی حاشیههای جراحی معمولاً در حین عمل ارزیابی میشود تا از کفایت برداشتن اطمینان حاصل شود. جریان خون شریانی پس از بازسازی بخیهدار بستر رزکسیون یا رنورافی و نزدیک کردن کپسول کلیه، بازسازی میشود. به طور جایگزین، چربی اطراف کلیه یا مواد هموستاتیک زیستتخریبپذیر به محل نقص بخیه زده میشود تا بهبود و هموستاز را تسریع کند. میزان بقای پنج ساله مختص سرطان پس از نفرکتومی جزئی برای بیماران مبتلا به بیماری مرحله I یا II به ترتیب تقریباً 90٪ و 80٪ است. در حال حاضر، نفرکتومی جزئی، استاندارد مراقبت از بیماران مبتلا به تومورهای کلیوی موضعی با اندازه کمتر از 4 سانتیمتر را تشکیل میدهد.
جراحی نفرونسپارینگ و نفرکتومی رادیکال، درمانهای درمانی مؤثر یکسانی را برای تومورهای منفرد، کوچک و کاملاً موضعی ارائه میدهند. نفرکتومی جزئی، میزان بقای 5 ساله مختص سرطان را از 92٪ تا 97٪ به همراه دارد. میزان عود تومور در بقایای کلیه از 0٪ تا 6٪ گزارش شده است. دادههای اخیر همچنین نشان میدهند که انجام نفرکتومی جزئی بر روی تومورهای آناتومیک مطلوب بین ۴ تا ۷ سانتیمتر امکانپذیر است و هنگامی که با دقت در مراکز عالی انجام شود، بقای اختصاصی سرطان معادل افرادی است که با نفرکتومی رادیکال درمان میشوند. مهمتر از آن، چندین محقق اخیراً گزارش دادهاند که نفرکتومی رادیکال در مقایسه با نفرکتومی جزئی با میزان بالاتری از عوارض قلبی عروقی، بیماری مزمن کلیه، مرگ و میر غیر سرطانی و مرگ و میر کلی همراه است و بر نقش جراحی حفظ نفرون در صورت امکان تأکید میکند.
نتیجه انکولوژیک نفرکتومی جزئی در یک کارآزمایی تصادفی، چند مرکزی و کنترلشده (EORTC 30904) برای ۵۴۱ بیمار با RCC کوچک (≤۵ سانتیمتر)، منفرد، T1-T2 N0 M0 با نفرکتومی رادیکال مقایسه شد. این مطالعه که به دلیل کمبود اطلاعات، پیش از موعد بسته شد، تجزیه و تحلیل قصد درمان (intention-to-treat) از میزان بقای کلی 10 ساله را برای نفرکتومی رادیکال 81.1٪ و برای جراحی با حفظ نفرون 75.7٪ نشان داد. با نسبت خطر 1.50، آزمون عدم پایینتر بودن معنیدار نبود (0.77 = p) و آزمون برتری معنیدار بود (0.03 = p). با این حال، در بیماران RCC (بیماران واجد شرایط بالینی و پاتولوژیک)، این تفاوت حتی کمتر بود (HR = 1.43 و HR = 1.34، به ترتیب) و روند به نفع نفرکتومی رادیکال دیگر معنیدار نبود (0.07 = p و 0.17 = p). این مطالعه نتیجه گرفت که هر دو روش نتایج انکولوژیک عالی ارائه میدهند.
پیشرفتهای اخیر در درمان جراحی RCC موضعی بر استراتژیهای کمتهاجمی متمرکز شدهاند. نفرکتومی رادیکال لاپاروسکوپی، که از طریق رویکردهای استاندارد، با کمک دست یا با کمک ربات انجام میشود، به استاندارد طلایی برای درمان بیماران مبتلا به RCC موضعی/پیشرفته موضعی تبدیل شده است که با رویکردهای حفظ نفرون قابل پذیرش نیستند. نفرکتومی جزئی لاپاروسکوپی خالص در برخی مراکز استفاده میشود، اگرچه بازسازی کلیه تحت محدودیتهای زمانهای ایسکمی گرم و افزایش خطر عوارض اورولوژیک مانع از جذب گسترده این تکنیک کم تهاجمی شده است. در دهه گذشته، نفرکتومی جزئی لاپاروسکوپی با کمک ربات در درمان تومورهای کوچک کلیوی جایگاه خود را پیدا کرده است، زیرا از نظر فنی نسبت به همتای لاپاروسکوپی خالص چالش کمتری دارد.
تحقیقات بالینی جدیدتر بر استراتژیهای تخریب انرژی مانند کرایوتراپی و تخریب فرکانس رادیویی، چه از طریق رویکردهای لاپاروسکوپی یا از راه پوست، به عنوان استراتژیهایی برای درمان تودههای کلیوی کوچک (کمتر از 4 سانتیمتر) متمرکز شدهاند. این استراتژیهای تخریب انرژی اخیراً نتایج میانمدت دلگرمکنندهای را گزارش کردهاند، اما دادههای مربوط به اثربخشی انکولوژیک بلندمدت هنوز کم است. این روشها به عنوان گزینهای برای بیمارانی که از جراحی امتناع میکنند یا زمانی که برداشتن تومور با جراحی منع شده است، در نظر گرفته میشوند. با این حال، تکنیکهای تخریب حرارتی برای تومورهای بزرگتر cT1b باید به دلیل فقدان شواهد طولانی مدت در مورد نتایج انکولوژیک، همچنان در مرحله تحقیق باقی بمانند. علاوه بر این، نظارت فعال بر تودههای کلیوی کمتر از 3 سانتیمتر به عنوان یک استراتژی مدیریتی جایگزین در بیماران منتخب و سالمندان با بیماریهای همراه شدید که نمیتوانند تحت عمل جراحی قرار گیرند، ظهور کرده است.
یک متاآنالیز اخیر از 10 مطالعهی نظارت فعال که شامل 331 بیمار مبتلا به RCC موضعی بود، میزان پیشرفت متاستاتیک کمتر از 2٪ را نشان داد که دلگرمکننده است. با این حال، نتایج بلندمدت چنین رویکردهایی هنوز در دست بررسی است.
در نفرکتومی رادیکال، کلیه، غده فوق کلیوی همان طرف (در صورت درگیری)، فاسیای ژروتا اطراف و غدد لنفاوی منطقهای همگی به صورت یکپارچه برداشته میشوند. اگرچه هیچ مطالعه تصادفی مزیت آن را نسبت به نفرکتومی ساده ثابت نکرده است، نفرکتومی رادیکال از نظر تئوری مزیت برداشتن غدد لنفاوی درون چربی پری نفریک را دارد. تا 10٪ از بیماران میتوانند شواهدی از متاستازهای لنفاوی منطقهای بدون بیماری دوردست داشته باشند، اگرچه میزان درگیری مخفی غدد لنفاوی در محدوده 3٪ تا 5٪ است. میزان بقای 5 ساله برای بیمارانی که غدد لنفاوی مثبت دارند از 8٪ تا 35٪ متغیر است. با این حال، بیمارانی که بافتشناسی پاپیلاری و متاستاز غدد لنفاوی دارند و تحت عمل جراحی تهاجمی قرار میگیرند، میتوانند از بقای طولانی مدت بدون پیشرفت و کلی بهرهمند شوند، برخلاف بیمارانی که متاستاز غدد لنفاوی از بافتشناسی سلول شفاف دارند.
لنفادنکتومی گسترده هرگز در بیمارانی که تحت عمل نفرکتومی رادیکال برای RCC موضعی در مراحل اولیه قرار میگیرند، به جز در مواردی که غدد لنفاوی از نظر بالینی مثبت هستند، مفید نبوده است و بسیاری از جراحان برای اطلاعات پیشآگهی، تشریح محدود غدد لنفاوی را که عوارض محدودی دارد، ترجیح میدهند. دادههای روشنی وجود دارد که نشان میدهد در صورت امکان، تمام شواهد بیماری آشکار باید در زمان نفرکتومی برداشته شود. با این حال، نتایج آزمایش فاز 3 تصادفی EORTC (30881) میزان بروز کمی (4.0٪) از متاستاز غدد لنفاوی غیرمشکوک قبل از عمل را نشان داد و هیچ تفاوت معنیداری در بقای کلی، زمان پیشرفت بیماری یا بقای بدون پیشرفت بین بیمارانی که تحت عمل نفرکتومی رادیکال با یا بدون تشریح کامل غدد لنفاوی قرار گرفتند، وجود نداشت. دستورالعملهای NCCN تشریح غدد لنفاوی منطقهای را برای بیمارانی که بیماری قابل لمس یا غدد بزرگ شدهای دارند که در تصویربرداری قبل از عمل شناسایی شدهاند، توصیه میکند.
رویکرد جراحی به نفرکتومی رادیکال با اندازه و محل تومور و ترجیح جراح تعیین میشود. میتوان از برش اصلاحشده پهلو، خط میانی یا زیر دندهای (شورون) استفاده کرد. تومورهای بزرگ قطب فوقانی را میتوان از طریق برش توراکو-ابدومینال برای دسترسی بیشتر به تومور، مورد بررسی قرار داد. اگر غده فوق کلیوی در تصویربرداری یا حین عمل دچار بدخیمی نشده باشد، معمولاً آدرنالکتومی توصیه نمیشود.
تقریباً 15 تا 20 درصد از RCCها به ورید کلیوی و 8 تا 15 درصد به ورید اجوف تحتانی حمله میکنند. تهاجم RCC به ورید کلیوی معمولاً مشکل جراحی قابل توجهی ایجاد نمیکند. با این حال، درگیری ورید اجوف تحتانی ممکن است نیاز به اقدامات گسترده اضافی برای برداشتن کامل تومور داشته باشد. ترومبوز ورید اجوف تحتانی را میتوان طبق طبقهبندی مایو به پنج سطح طبقهبندی کرد: سطح 0، ترومبوز فقط در داخل ورید کلیوی است. سطح I (کلیوی)، ترومبوز به داخل IVC گسترش مییابد اما بیش از 2 سانتیمتر بالاتر از ورید کلیوی نیست.
سطح II (زیر کبدی)، ترومبوز به داخل IVC تا بیش از 2 سانتیمتر بالای ورید کلیوی گسترش مییابد اما به ورید کبدی نمیرسد؛ سطح III (داخل کبدی)، ترومبوز به داخل IVC تا بالای ورید کبدی گسترش مییابد اما به دیافراگم نمیرسد؛ و سطح IV، ترومبوز به داخل IVC فوق دیافراگمی یا دهلیز راست گسترش مییابد. در مواردی که ورید اجوف فوقانی درگیر است، ضروری است که جراح با تکنیکهای جراحی عروق آشنا باشد و باید مشاوره با یک جراح قلب و عروق، به ویژه برای ترومبوز سطح 3-4، در نظر گرفته شود. بایپس قلبی ریوی، ایست هیپوترمی عمیق و بایپس وریدی-وریدی در برداشتن این تومورهای پیشرفته موضعی که به ورید اجوف فوقانی گسترش مییابند، استفاده شدهاند.
کارسینوم متاستاتیک سلول کلیوی
تقریباً 40 تا 50 درصد از بیماران یا با متاستاز مراجعه میکنند یا در طول سیر طبیعی بیماری خود دچار متاستاز میشوند. میانگین بقای بیماران مبتلا به RCC متاستاتیک ۱۲ ماه است. دو کارآزمایی تصادفی فاز ۳، بهبود قابل توجهی در بقای بیمارانی که قبل از تجویز اینترفرون آلفای سیستمیک در بیمارانی که بیماری متاستاتیک و تومور اولیه درجا دارند، تحت عمل نفرکتومی سیتورداکتیو قرار میگیرند، نشان دادهاند. وجود متاستازهای غدد لنفاوی، در شرایط بیماری متاستاتیک دوردست، نشاندهنده پیشآگهی بدتر و احتمال کاهش پاسخ به درمان سیستمیک است که ممکن است با برداشتن جراحی تهاجمی غدد لنفاوی در زمان جراحی سیتورداکتیو تغییر کند.
بیماری متاستاتیک دوردست را میتوان به عنوان بیماری الیگومتاستاتیک یا بیماری متاستاتیک حجیم طبقهبندی کرد. مطالعات متعددی میزان بقای ۳ ساله بالاتری را نشان دادهاند که از ۲۰٪ تا ۶۰٪ متغیر است، پس از نفرکتومی رادیکال با برداشتن متاستاز منفرد. به نظر میرسد متاستازهای منفرد ریه با میزان بقای بهتری نسبت به متاستاز به سایر اندامها همراه هستند.
متاستازهای متعدد یا محلهای متعدد متاستاز، پیشآگهی بسیار بدتری را نشان میدهند و معمولاً با گزینههای درمانی سیستمیک درمان میشوند، اگرچه مزیت تثبیت جراحی پس از حداکثر پاسخ به درمان سیستمیک در بیماران منتخب مبتلا به RCC متاستاتیک نشان داده شده است.
شیمیدرمانی سیتوتوکسیک تا حد زیادی در RCC بیاثر بوده است؛ بالاترین میزان پاسخ عینی برای درمان تکدارویی تنها 16٪ است. اخیراً، رژیمهای درمانی با جمسیتابین و کاپسیتابین فعالیت قابل توجهی را در بیماران منتخب نشان دادهاند. اینترلوکین-2 (IL-2) در آزمایشهای مختلف، در درجه اول با استفاده از رژیمهای داخل وریدی بولوس با دوز بالا، میزان پاسخ پایدار 15٪ تا 19٪ را به همراه داشته است. اعتقاد بر این است که IL-2 زیر جلدی، چه به تنهایی و چه در ترکیب با اینترفرون، نسبت به رژیمهای داخل وریدی IL-2 پایینتر است، اما با سمیت قابل توجهی کمتری همراه است.
تا همین اواخر، IL-2 استاندارد طلایی درمان برای بیماران مبتلا به بیماری متاستاتیک بود، اما پیشرفتهای اخیر در درک مسیرهای مولکولی مرتبط با سرطانزایی و پیشرفت سلولهای کلیوی منجر به توسعه درمانهای هدفمند مولکولی خاص شده است که به سرعت جایگزین IL-2 در مجموعه تجهیزات انکولوژیست شدهاند. از سال ۲۰۰۵، چندین دارو (بواسیزوماب، سونیتینیب، سورافنیب، پازوپانیب، آکسیتینیب، کابوزانتینیب، لنواتینیب، تمسیرولیموس، اورولیموس، نیوولوماب) برای درمان RCC متاستاتیک تأیید شدهاند. استفاده از این داروها به بافتشناسی، درمانهای قبلی دریافت شده و ناموفق، و طبقهبندی خطر بیمار بستگی دارد. متأسفانه، این داروها، در بهترین حالت، فقط در برخی از بیماران پاسخهای جزئی ایجاد میکنند و موارد بسیار نادری از پاسخهای کامل وجود دارد. در حال حاضر تحقیقات زیادی در زمینه درمان هدفمند در حال انجام است و بسیاری از عوامل هدفمند جدید در حال توسعه هستند.
سرطان بیضه
اپیدمیولوژی و علتشناسی
تومورهای بدخیم بیضه نادر هستند. گزارش شده است که تقریباً ۸۷۲۰ مورد سرطان بیضه در سال ۲۰۱۶ تشخیص داده شده است، اما تنها ۳۸۰ مرد بر اثر این بیماری جان خود را از دست خواهند داد. نود و پنج درصد از این تومورها منشأ سلولهای زایا دارند. اگرچه تومورهای بیضه میتوانند در هر سنی رخ دهند، انواع خاصی از تومورها در سنین مختلف رخ میدهند. کوریوکارسینوماها معمولاً بین ۲۴ تا ۲۸ سالگی، کارسینوماهای جنینی از ۲۶ تا ۳۴ سالگی، سمینوماها از ۳۲ تا ۴۲ سالگی و لنفومها و سمینوماهای اسپرماتوسیتی بعد از ۵۰ سالگی رخ میدهند.
شناختهشدهترین عامل اتیولوژیک در ایجاد سرطان بیضه، کریپتورکیدیسم است. بین ۳ تا ۱۱ درصد از کل موارد سرطان بیضه در بیضههای کریپتورکید رخ میدهد. عوامل ژنتیکی نیز ممکن است نقش مهمی داشته باشند. CIS (که به عنوان نئوپلازی سلول زایا درون لولهای نیز شناخته میشود) پیشساز سرطان سلول زایا بیضه است. در مجموع ۵ تا ۶ درصد از مردان مبتلا به تومور سلول زایا یک طرفه، CIS را در بیضه طرف مقابل دارند و در ۵۰ درصد از این مردان، تومور سلول زایا ایجاد میشود. سایر مردانی که در معرض خطر بالای CIS هستند، افرادی با دوجنسیتی بودن، کریپتورکیدیسم، ناباروری یا تومور سلول زایا خارج از غدد جنسی هستند.
تظاهرات بالینی
سرطان بیضه معمولاً به صورت توده بیضه بدون درد و/یا بزرگ شدن آن بروز میکند. بیماری پیشرفته میتواند به صورت درد کمر، درد پهلو یا با علائم سیستمیک بروز کند. تشخیص افتراقی شامل واریکوسل، هیدروسل، هماتوم، اپیدیدیمیت، ارکیت و فتق کشاله ران است.
تشخیص
اگرچه تشخیص معمولاً در معاینه فیزیکی توسط یک پزشک باتجربه آشکار میشود، اما سونوگرافی اسکروتوم باید برای تأیید تشخیص، ارزیابی گسترش موضعی و ارزیابی بیضه مقابل انجام شود.
هر توده بیضه جامد تا زمانی که خلاف آن ثابت شود، تومور بیضه در نظر گرفته میشود. بیماران مبتلا به بزرگ شدن بیضه که گمان میرود ماهیت التهابی داشته باشد (اپیدیدیمو-ارکیت) باید پس از درمان عفونت، مجدداً معاینه شوند تا وجود توده بیضه مخفی رد شود. به محض اینکه به تومور بیضه مشکوک شد، باید سطح نشانگرهای تومور آلفا فتوپروتئین (AFP)، گنادوتروپین جفتی انسان (hCG) و لاکتات دهیدروژناز (LDH) در بیمار آزمایش شود. پس از آن، بیمار باید تحت عمل جراحی ارکیکتومی رادیکال اینگوینال قرار گیرد. آسپیراسیون با سوزن ظریف یا بیوپسی Tru-cut در بررسی این بیماری نقشی ندارد.
قبل یا بعد از ارکیکتومی رادیکال، باید در همه بیماران سی تی اسکن مرحلهای از قفسه سینه، شکم و لگن و همچنین نشانگرهای تومور سرمی پس از ارکیکتومی (که حداقل 4 هفته پس از جراحی گرفته میشوند) برای طبقهبندی خطر جهت هدایت درمان بعدی انجام شود. به عنوان یک روش جایگزین، میتوان در بیمارانی که خطر کمی برای متاستاز قفسه سینه دارند، مانند بیمارانی که نشانگرهای تومور پس از ارکیکتومی طبیعی دارند و سی تی اسکن شکم/لگن آنها طبیعی است، رادیوگرافی قفسه سینه انجام داد. افزایش نشانگرهای تومور سرم باید پس از برداشتن بیضه و در صورت امکان، پس از زمان مناسب برای بازگشت هر نشانگر به حالت اولیه، برای مرحلهبندی دقیق، پیگیری شود. این زمان تقریباً ۱ هفته برای hCG و ۵ هفته برای AFP خواهد بود.
قبل از انجام مداخلات درمانی که ممکن است پتانسیل باروری را کاهش دهند، مانند برداشتن غدد لنفاوی خلف صفاق (RPLND)، پرتودرمانی یا شیمیدرمانی، باید در مورد ذخیره اسپرم قبل از عمل با بیمارانی که به باروری در آینده علاقهمند هستند، صحبت شود.
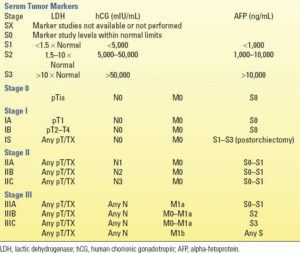
مرحلهبندی
سیستم مرحلهبندی سرطان بیضه TNM کمیته مشترک سرطان آمریکا در جدول 19.5 شرح داده شده است. از نظر رفتار بیولوژیکی و درمان، تومورهای بیضه را میتوان به تومورهای سلول زایا سمینوماتوس یا غیر سمینوماتوس (NSGCT) طبقهبندی کرد. سمینوماها تومورهای حساس به تابش و حساس به شیمیدرمانی هستند که به طور منظم در لنفاوی پخش میشوند. در مقابل، NSGCTها حداقل به تابش حساس هستند و پتانسیل متاستاز بالاتری نسبت به سمینوماها دارند.
مدیریت
تومورهای سلول زایا سمینوماتوس
پس از ارکیکتومی رادیکال، گزینههای مدیریت استاندارد برای سمینوماهای مرحله I یا ثبت نام در نظارت فعال (ترجیحاً برای بیماری pT1-pT3) است که نیاز به بیمار بسیار مطیع دارد، یا درمان با شیمیدرمانی تک عاملی کاربوپلاتین یا پرتودرمانی به غدد لنفاوی خلف صفاقی تا سطح دیافراگم (دوزهای حدود 20 گری).
میزان بقای اختصاصی سرطان برای سمینوما مرحله I صرف نظر از روش درمانی مورد استفاده، 99٪ است. سمینوماهای مرحله II با پرتودرمانی به غدد لنفاوی خلف صفاق و غدد لنفاوی لگنی همان طرف تا سطح دیافراگم درمان میشوند (دوزهای 30 گری برای مرحله IIA تا 36 گری برای مرحله IIB با حجم کم). میزان بقای کلی با پرتودرمانی برای مرحله II تقریباً 100٪ است. اگرچه 5 تا 6 درصد از بیماران مبتلا به بیماری مرحله IIA عود میکنند، اما بیش از نیمی از آنها با موفقیت به درمان نجاتبخش پاسخ میدهند. در مقابل، شیمیدرمانی مبتنی بر سیس پلاتین جایگزین درمانی ترجیحی برای سمینوما مرحله IIB است.
بیماریهای مرحله IIC و III معمولاً با شیمیدرمانی اولیه با بلئومایسین، اتوپوزید و سیس پلاتین (BEP) درمان میشوند. جراحی عموماً برای بیماری لنفاوی (که معمولاً در اسکنهای PET/CT پس از شیمیدرمانی ثبت میشود) که به شیمیدرمانی یا پرتودرمانی پاسخ نمیدهد، در نظر گرفته میشود و به ندرت در زمینه سمینوم متاستاتیک پس از پرتودرمانی و/یا شیمیدرمانی انجام میشود. با استفاده از این رویکرد، میزان بقای ۵ ساله بدون بیماری به ترتیب ۸۶٪ و ۹۲٪ برای بیماران مبتلا به بیماری مرحله IIB و III به دست آمده است.
| جدول19.5 سیستمهای مرحلهبندی سرطان بیضه |
 |
 |
تومورهای سلول زایا غیر سمینوماتوس
استراتژیهای مدیریتی برای بیماری مرحله IA شامل نظارت و RPLND با حفظ عصب است. در حالی که این دو گزینه برای NSGCT مرحله IB در نظر گرفته میشوند، شیمیدرمانی سیستمیک اولیه گزینه دیگری برای کاهش خطر عود در این بیماران است. در مجموع، تقریباً 20 تا 30 درصد از بیماران مبتلا به بیماری مرحله I که تحت نظارت قرار میگیرند، عود را تجربه میکنند. بیمارانی که در معرض خطر بالای عود هستند، شامل افرادی هستند که تهاجم لنفاوی عروقی یا بافتشناسی جنینی غالب در تومور اولیه دارند.
میزان عود پس از RPLND برای بیماری کم حجم مرحله II کمتر از 20 درصد است. بنابراین، هم RPLND و هم شیمیدرمانی سیستمیک اولیه برای درمان بیماری کم حجم خلف صفاقی استفاده شدهاند. میزان بقای 97 درصد یا بیشتر با هر دو نوع درمان مرتبط بوده است. در مرکز سرطان MD Anderson، بیماران مبتلا به بیماری مرحله II با شیمیدرمانی اولیه درمان میشوند و RPLND برای ریشهکنی بعدی بیماری باقیمانده استفاده میشود. به دلیل میزان بالای عود مرتبط با RPLND اولیه به تنهایی در بیماران مبتلا به NSGCT های مرحله IIB، IIC و III با حجم بالا، شیمی درمانی سیستمیک اولیه درمان انتخابی برای این بیماری است.
از RPLND برای از بین بردن هرگونه بیماری باقیمانده که ممکن است پس از شیمی درمانی اولیه وجود داشته باشد و برای تعیین نیاز به درمان بیشتر استفاده میشود. تجربه اخیر با شیمی درمانی برای NSGCT پیشرفته در MD مرکز سرطان اندرسون، میزان بقای 5 ساله 96٪ و 76٪ را به ترتیب برای بیماری مرحله III با حجم کم و زیاد نشان داده است.
با وجود سن نسبتاً پایین شروع سرطان بیضه، این بیماری همچنان یکی از قابل درمان ترین سرطان ها است. اکثر NSGCT ها یا AFP یا β-hCG تولید می کنند که این نشانگرها را در نظارت بر بیمار برای پاسخ به درمان و عود بیماری مفید می کند. RPLND را می توان در شرایط اولیه (قبل از شیمی درمانی، معمولاً در NSGCT های مرحله I و IIA) با حفظ عالی اعصاب سمپاتیک و در نتیجه حفظ عملکرد انزال انجام داد. RPLND در این شرایط با استفاده از الگوهای اصلاحشده (و نه فقط یک برداشت توده) انجام میشود.
برای تودههای باقیمانده پس از شیمیدرمانی (در شرایط نشانگرهای طبیعی)، RPLND پس از شیمیدرمانی با هدف برداشتن هرگونه غدد لنفاوی خلف صفاقی، از جمله هرگونه تومور یا تراتوم زنده باقیمانده انجام میشود. تراتومها میتوانند تهدیدکننده زندگی باشند، زیرا میتوانند خیلی سریع رشد کنند (سندرم تراتوم در حال رشد)، به اندامهای حیاتی مجاور حمله کنند، به سارکوم یا کارسینوم (تبدیل بدخیم سوماتیک) تبدیل شوند و در برابر شیمیدرمانی و پرتودرمانی مقاوم باشند. تراتومها فقط با برداشتن جراحی جامع و کامل قابل درمان هستند. معمولاً در RPLND پس از شیمیدرمانی، یک الگوی کامل دو طرفه انجام میشود که هدف آن برداشتن تمام غدد لنفاوی خلف صفاقی است. RPLND پس از شیمیدرمانی یک روش فنی چالشبرانگیز است که فقط باید در مراکز باتجربه انجام شود، زیرا با میزان عوارض بالاتر همراه است و میتواند در 25٪ موارد نیاز به برداشتن اندامهای درگیر مجاور (کلیه، حالب، طحال، ورید اجوف تحتانی، روده بزرگ) داشته باشد.

بدون دیدگاه