اپیدمیولوژی
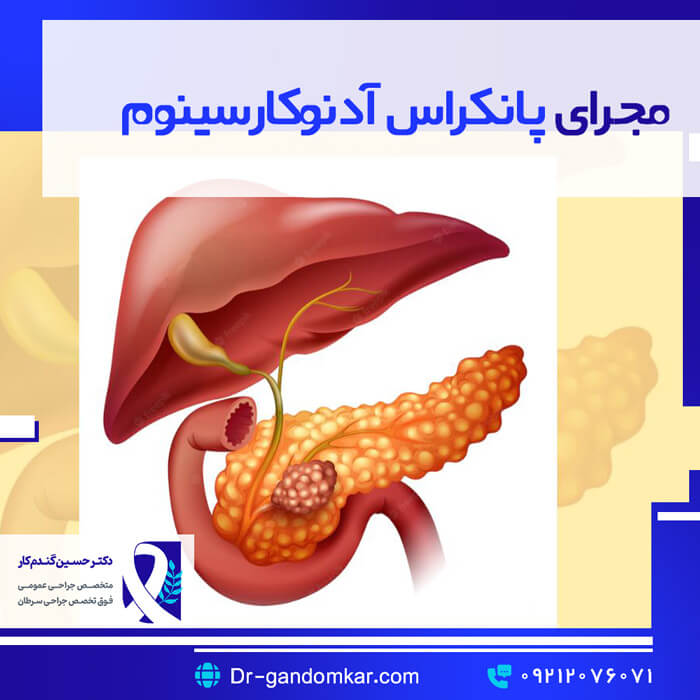
آدنوکارسینوم مجرای پانکراس (PDAC) شایعترین سرطان تهاجمی پانکراس است. این بیماری سومین علت شایع مرگ ناشی از سرطان در ایالات متحده است که سالانه 12.4 مورد در هر 100000 نفر را شامل میشود. پیشبینی میشود که PDAC تا سال 2020 از سرطان کولورکتال پیشی گرفته و به دومین علت اصلی مرگ ناشی از سرطان در ایالات متحده تبدیل شود. خطر کلی ابتلا به سرطان پانکراس پس از 50 سالگی افزایش مییابد و میانگین سن تشخیص 70 سال است. با وجود پیشرفتهای اخیر در درمان PDAC، میزان بقای کلی 5 ساله همچنان 7.7 درصد است که تا حدی به این دلیل است که اکثر بیماران با بیماری پیشرفتهای مراجعه میکنند که مانع از درمان قطعی میشود. بنابراین شناسایی جمعیتهای بیمار در معرض خطر بیشتر PDAC، امکان تشخیص زودهنگام و استفاده از درمانهای هدفمند در حال تکامل را فراهم میکند. عوامل خطر متعددی شناسایی شدهاند که خطر ابتلا به سرطان پانکراس (PDAC) را افزایش میدهند، از جمله سندرمهای سرطانی ارثی ژنتیکی و عوامل محیطی متنوع. سندرمهای سرطان ارثی مرتبط با سرطان پانکراس شامل سندرم پوتز-جگرز (تا ۱۳۲ برابر خطر)، سندرم سرطان پستان-تخمدان ارثی (مرتبط با جهشهای BRCA1 یا BRCA2، تا ۳.۵ برابر خطر)، سندرم ملانومای خال چندگانه غیرمعمول خانوادگی (FAMM، تا ۳۲ برابر خطر) و سندرم سرطان روده بزرگ غیرپولیپی ارثی (HNPCC، ۹ برابر خطر) است.
تا ۱۰٪ از کل سرطانهای پانکراس خانوادگی هستند و به نظر میرسد خطر ابتلا به سرطان پانکراس در فرد با نفوذ آن در بین اعضای خانواده مرتبط افزایش مییابد. بنابراین، شناسایی جمعیتهای بیمار با استعداد ژنتیکی به PDAC ممکن است از طریق نظارت تهاجمی بر بیماری و تشخیص زودهنگام، نتایج بیمار را بهبود بخشد. عوامل خطر مهم برای سرطان پانکراس پراکنده شامل سیگار کشیدن، اعتیاد به الکل و پانکراتیت مزمن است. یک مطالعه مورد-شاهدی روی بیش از 1600 بیمار نشان داد که سیگار کشیدن و دیابت به همراه سابقه خانوادگی به طور هم افزایی خطر ابتلا به PDAC را افزایش میدهند. یک مطالعه بزرگ دیگر نشان داد که دیابت شیرین و غلظت بالای انسولین با دو برابر شدن خطر ابتلا به PDAC مرتبط هستند.
با وجود شناسایی چندین عامل خطر برای این بیماری، غربالگری PDAC در جمعیت عمومی به دلیل شیوع نسبتاً کم آن و عدم وجود زیرگروههای بیمار مشخص در معرض خطر بالای این بیماری، از نظر لجستیکی و مالی غیرعملی است.
تظاهرات بالینی
تظاهرات بالینی سرطان پانکراس متغیر و غیراختصاصی است. شایعترین علامت در زمان مراجعه، زردی مربوط به انسداد صفراوی خارج کبدی است که در حداکثر 50٪ از کل بیماران مبتلا به PDAC رخ میدهد و در بیماران مبتلا به سرطانهای سر پانکراس حتی شایعتر است. شکایات غیر اختصاصی شامل علائم عمومی، کاهش وزن و درد شکم است که اغلب به پشت انتشار مییابد. بسیاری از بیمارانی که سرطان پانکراس در آنها تشخیص داده شده است، اخیراً به دیابت مبتلا شدهاند که ممکن است مربوط به اختلال عملکرد سلولهای بتا و/یا مقاومت به انسولین محیطی ناشی از عوامل مشتق شده از تومور، مانند آدرنومدولین یا پلی پپتید آمیلوئید جزایر لانگرهانس باشد.
علائم مرتبط با PDAC اغلب نشان دهنده مرحله بیماری و پیش آگهی کلی هستند. به عنوان مثال، درد قبل از عمل معمولاً نشان دهنده سرطان پیشرفته است. کلسن و همکارانش دریافتند که بیمارانی که با درد مراجعه کردهاند، صرف نظر از وضعیت قابل برداشتن بودن تومورهایشان، میانگین بقای کلی کوتاهتری نسبت به بیمارانی که درد نداشتند، داشتند. بیماران همچنین ممکن است یافتههای فیزیکی داشته باشند که ممکن است در ارزیابی مرحله و پیش آگهی بیماری مفید باشد. بیمارانی که با کاشکسی مراجعه میکنند، کمتر احتمال دارد که تحت عمل جراحی قرار گیرند و بقای بدتری نسبت به بیمارانی که در زمان مراجعه کاشکسی ندارند، دارند.
سایر علائم ظریف بیماری متاستاتیک شامل بزرگ شدن غدد لنفاوی فوق ترقوه ای چپ (گره ویرچو) یا غدد لنفاوی اطراف ناف (گره خواهر مری جوزف) است. معاینه رکتوم ممکن است یک قفسه بلومر را نشان دهد که ممکن است نشان دهنده رسوبات تومور داخل صفاقی باشد. آسیت، یک یافته شایع تر، ممکن است نشان دهنده کارسینوماتوز باشد. به ندرت، بیماران مبتلا به بیماری پیشرفته با ندول های پوستی مراجعه می کنند.
تشخیص و مرحله بندی
اهداف اساسی ارزیابی اولیه بیمار مبتلا به توده پانکراس مشکوک به PDAC عبارتند از: (الف) اطمینان از تشخیص هیستوپاتولوژیک، (ب) مرحله بندی بیماری و (ج) تخمین مشخصات فیزیولوژیکی بیمار. تنها پس از برآورده شدن این اهداف اساسی است که می توان توصیه های درمانی منطقی ارائه داد.
تصویربرداری مقطعی
توموگرافی کامپیوتری (CT) همچنان مهمترین روش تصویربرداری در بررسی تشخیصی بیماران مشکوک به سرطان پانکراس است. سیتیاسکن میتواند توده پانکراس را شناسایی کند، روابط آناتومیک مهم بین توده و عروق مزانتریک را مشخص کند و محلهای بیماری متاستاتیک را شناسایی کند.
در مرکز سرطان ام دی اندرسون (MDACC)، سی تی اسکن با پروتکل پانکراس از آب به عنوان ماده حاجب خوراکی منفی استفاده میکند و با تصویربرداری پیش از تزریق ماده حاجب از گنبد کبد شروع میشود که به سمت خلف امتداد مییابد و کل کبد بازسازی شده را با ضخامت برش ۲.۵ میلیمتری در بر میگیرد.
در مرحله بعد، ۱۲۵ میلیلیتر ماده حاجب یددار با سرعت ۳ تا ۵ میلیلیتر در ثانیه به صورت داخل وریدی تجویز میشود. مرحله شریانی از ردیابی بولوس استفاده میکند و تصاویر ۱۰ ثانیه پس از رسیدن به مقدار واحد هانسفیلد ۱۰۰ در آئورت در سطح محور سلیاک، از گنبد کبد تا ستیغهای ایلیاک، گرفته میشوند. تصاویر مربوط به مرحله وریدی پورتال با تأخیر ۲۰ ثانیهای از مرحله شریانی گرفته میشوند. تصاویر تأخیری ۱۵ ثانیه پس از مرحله وریدی پورتال گرفته میشوند. تصاویر برای بررسی تصویربرداری با ضخامت برش ۲.۵ میلیمتری و برای ایجاد تصاویر اصلاحشده کرونال و ساژیتال با ضخامت برش ۰.۶۲۵ یا ۱.۲۵ میلیمتر بازسازی میشوند. تومور اولیه پانکراس در فاز شریانی سیتیاسکن به بهترین شکل دیده میشود و معمولاً به صورت یک توده هیپودنس در مقابل پارانشیم طبیعی پانکراس که آن را احاطه کرده و کنتراست نسبتاً بالایی دارد، ظاهر میشود.
باید توجه ویژهای به آناتومی دقیق عروقی و روابط آناتومیکی بین عروق مزانتریک و تومور اولیه پانکراس مبذول شود. 40 تا 45 درصد از بیماران دارای انواع آناتومی شریان کبدی “طبیعی” هستند و درک چنین انواعی در تصویربرداری قبل از عمل بسیار مهم است زیرا مستقیماً بر برنامهریزی عمل تأثیر میگذارند. نمونههای قابل توجه شامل شریان کبدی راست جایگزین شده یا فرعی است که در حداکثر 15 درصد از بیماران وجود دارد و معمولاً از SMA ناشی میشود و در خلف پانکراس و در خلف جانبی مجرای صفراوی امتداد مییابد. 2.5 درصد دیگر از بیماران دارای شریان کبدی مشترک جایگزین شده هستند که از SMA ناشی میشود و مسیری مشابه شریان کبدی راست جایگزین شده یا فرعی را طی میکند. ورید مزانتریک فوقانی (SMV) و ورید پورتال (PV) و همچنین شاخههای اصلی وریدی آنها، به بهترین وجه در فاز ورید پورتال ارزیابی میشوند. سیتیاسکن مرحلهبندی اولیه حساسیت و ویژگی بالایی برای تعیین درگیری وریدی توسط تومور دارد و جراح باید به دقت میزان محیطی رابط تومور-وریدی را تخمین بزند و همچنین به کانتور ورید و وجود یا عدم وجود بدشکلی توجه کند.
تران کائو و همکارانش سیتیاسکن قبل از عمل 254 بیمار را که تحت عمل پانکراتودئودنکتومی برای PDAC قرار گرفته بودند، ارزیابی کردند و سطح مشترک تومور-وریدی را به صورت بدون زاویه، ≤180 درجه، >180 درجه یا همراه با انسداد وریدی اندازهگیری کردند. نیاز به برداشتن ورید با میزان سطح مشترک محیطی مرتبط بود. به عنوان مثال، 34 نفر از 38 بیمار (89٪) با سطح مشترک تومور-وریدی >180 درجه یا انسداد وریدی، نیاز به برداشتن ورید در پانکراتکتومی داشتند. جراح همچنین باید محل و روابط آناتومیک ورید معده، وریدهای کولیک، ورید مزانتریک تحتانی (IMV) و شاخههای ژژنوم/ایلئال SMV را مشخص کند، زیرا این شاخهها دارای مسیرهای متغیری هستند و الگوی تخلیه مستقیماً بر گزینههای جراحی برای بازسازی محل تلاقی ورید مزانتریک فوقانی-پورتال (SMV-PV) تأثیر میگذارد، که میتوان انتظار داشت در 40 تا 60 درصد موارد در مراکز با حجم بالا انجام شود. متاستازهای کبدی معمولاً در فاز ورید پورتال سیتیاسکن به بهترین شکل قابل مشاهده هستند. متاستازهای کبدی ممکن است با استفاده از تصویربرداری رزونانس مغناطیسی (MRI) که به عنوان کمکی برای تصویربرداری سیتیاسکن مفیدترین است، بهتر مشخص شوند. MRI نباید جایگزین سیتیاسکن پروتکل پانکراس در بررسی/مرحلهبندی بیمار مشکوک به PDAC شود، اگرچه ممکن است در بیماران مبتلا به بیماری مزمن کلیه گزینه بهتری باشد.
تعاریف قابلیت جراحی
برداشتن تومور در طول سالها، تیم چند رشتهای در MDACC معیارهای تصویربرداری را تعریف کردهاند که تومورها را بر اساس رابطه آناتومیک بین تومور اولیه و عروق مزانتریک مجاور، به عنوان قابل برداشتن بالینی، قابل برداشتن مرزی و پیشرفته موضعی توصیف میکنند. چندین گروه و انجمن دیگر تعاریف مشابهی ارائه دادهاند؛ خلاصهای از تعاریف مختلف رادیوگرافی از PDAC قابل برداشتن مرزی را میتوان در جدول 14.1 یافت. تومورهایی که از نظر آناتومیک کمتر از این موارد نفوذی هستند، قابل برداشتن در نظر گرفته میشوند و تومورهایی که نفوذیتر هستند، پیشرفته موضعی و عموماً غیرقابل برداشتن در نظر گرفته میشوند.
سونوگرافی آندوسکوپی
سونوگرافی آندوسکوپی (EUS) ممکن است به تشخیص کمک کند و به ویژه در ارزیابی ضایعات کوچکتر پانکراس ارزشمند است: EUS دارای حساسیت کلی 99٪ و حساسیت 96٪ برای تومورهای با قطر کمتر از 2 سانتیمتر است. EUS همچنین میتواند برای کمک به ارزیابی ارتباط تومور اولیه با عروق مزانتریک و درگیری غدد لنفاوی منطقهای مورد استفاده قرار گیرد. بیوپسی آسپیراسیون با سوزن ظریف تحت هدایت EUS روش ترجیحی برای اطمینان از تشخیص بافت تومور اولیه و هرگونه غدد لنفاوی منطقهای مشکوک است.
اگرچه تأیید تشخیص ممکن است همیشه در بیماران مشکوک به PDAC که پیشبینی میشود تحت عمل جراحی فوری قرار گیرند، ضروری نباشد، اما ما معمولاً آن را برای رد سایر تشخیصها (مانند پانکراتیت کانونی، لنفوم، پانکراتیت ایدیوپاتیک) که ممکن است به عنوان PDAC تظاهر کنند اما بهتر است به صورت غیرجراحی درمان شوند، توصیه میکنیم. علاوه بر این، قبل از تجویز شیمیدرمانی یا شیمیدرمانی، تشخیص بافتی لازم است.
CA 19-9 سرم
نشانگر تومور سرم که اغلب در بررسی بیماران مشکوک به سرطان پانکراس مورد سنجش قرار میگیرد، آنتیژن کربوهیدرات (CA) 19-9، یک آنتیژن مرتبط با گروه خونی گانگلیوزید لوئیس است. بیمارانی که آنتیژن لوئیس منفی هستند (حدود 10٪ از جمعیت) CA 19-9 را بیان نمیکنند. اگرچه CA 19-9 به عنوان یک ابزار غربالگری مفید نیست، اما به عنوان یک ابزار تشخیصی ارزشمند است و همچنین میتواند برای نظارت بر پاسخ به درمان استفاده شود. انسداد صفراوی به هر دلیلی ممکن است منجر به افزایش سطح CA 19-9 شود؛ بنابراین، بیلیروبین سرم همیشه باید در کنار CA 19-9 سرم اندازهگیری شود.
ویژگی تشخیصی CA 19-9 ممکن است در حضور سایر یافتههای تشخیصی افزایش یابد. به عنوان مثال، یک تجزیه و تحلیل گذشتهنگر از 150 بیمار که به دلیل مشکوک به سرطان پانکراس تحت عمل جراحی قرار گرفتند، نشان داد که ترکیب سطح CA 19-9 سرم >37 U/mL، کاهش وزن >20 پوند و سطح بیلیروبین سرم >3 میلیگرم در دسیلیتر با حساسیت 100٪ و ارزش پیشبینی مثبت 100٪ برای سرطان پانکراس همراه است. بنابراین، سطح CA 19-9 همیشه باید با توجه به سایر یافتههای بالینی و رادیوگرافی تفسیر شود.
| جدول 14.1 تعاریف PDACa قابل برداشت مرزی |
 |
CA 19-9 ممکن است به مرحلهبندی بالینی PDAC کمک کند و سطح آن در خون باید بر توصیههای درمانی تأثیر بگذارد. فرون و همکارانش سطح CA 19-9 را در مجموعهای از بیماران مبتلا به سرطان پانکراس با سطح بیلیروبین سرم کمتر از 2 میلیگرم در دسیلیتر که تحت عمل جراحی de novo قرار گرفتند، تجزیه و تحلیل کردند و دریافتند که سطح CA 19-9 قبل از عمل با مرحله T، مرحله N و میزان بقا همبستگی دارد. برگکویست و همکارانش با استفاده از پایگاه داده ملی سرطان دریافتند که افزایش CA 19-9 با کاهش بقای اختصاصی مرحله مرتبط است، که در بیماران مبتلا به سرطان در مراحل اولیه (I/II) بسیار چشمگیر بود. مایتل و همکارانش دریافتند که افزایش CA 19-9 با شناسایی بیماری غیرقابل جراحی مخفی از نظر رادیوگرافی مرتبط است. بنابراین، سطح بالای CA 19-9 سرم صرف نظر از یافتههای تصویربرداری، نشاندهنده بیماری پیشرفته است. در MDACC، سطح بالای CA 19-9 باعث میشود که شیمیدرمانی سیستمیک قبل از عمل برای بیماری با PDAC موضعی، حتی در غیاب شواهد رادیوگرافیک بیماری متاستاتیک، تجویز شود. پس از شروع درمان، تغییر در CA 19-9 در پاسخ به درمان، به عنوان شاخصی از اثربخشی درمان استفاده میشود.
لاپاراسکوپی مرحلهبندی
مطالعات متعددی استفاده از لاپاراسکوپی مرحلهبندی را برای شناسایی متاستازهای کوچک کبدی و صفاقی که توسط سیتیاسکن تشخیص داده نشدهاند، تأیید کردهاند. اگرچه برخی مطالعات نشان دادهاند که لاپاراسکوپی مدیریت تا 44٪ از بیماران مبتلا به PDAC قابل برداشت با رادیوگرافی را تغییر داده است، اما با بهبود تکنیکهای تصویربرداری، بازده لاپاراسکوپی برای مرحلهبندی سرطان کاهش یافته است. یک مطالعه در سال 2001 نشان داد که یافتههای لاپاراسکوپی باعث شده است که تنها در 4٪ تا 13٪ از بیمارانی که بیماری آنها از نظر رادیوگرافی قابل برداشت تشخیص داده شده بود، از لاپاراتومی اجتناب شود. اخیراً، یک مطالعه بزرگ روی بیش از ۱۰۰۰ بیمار نشان داد که لاپاراسکوپی حتی از مزایای کمتری برخوردار است، به خصوص در میان بیمارانی که اخیراً سیتیاسکن با کیفیت بالا برایشان انجام شده بود.
در MDACC، ما معمولاً لاپاراسکوپی را برای بیمارانی با تومورهای اولیه بزرگ، بیماران مبتلا به سرطان در بدنه یا دم پانکراس، بیماران با سطح CA 19-9 به طور قابل توجهی بالا، بیماران با سابقه کاهش وزن شدید و هیپوآلبومینمی و بیمارانی که یافتههای رادیوگرافی آنها برای وجود بیماری متاستاتیک یا کارسینوماتوز مبهم است، در نظر میگیریم. ما ممکن است لاپاراسکوپی مرحلهای را به عنوان یک روش جداگانه انجام دهیم. با این حال، با توجه به سادگی و عوارض کم همراه آن، لاپاراسکوپی مرحلهای اغلب قبل از لاپاراتومی برنامهریزی شده تحت همان بیهوشی انجام میشود. ما همچنین از لاپاراسکوپی مرحلهای به صورت انتخابی در بیمارانی با بیماری پیشرفته موضعی رادیوگرافیک (یعنی برای رد متاستازها قبل از تجویز رادیوتراپی به تومور اولیه و غدد لنفاوی منطقهای) استفاده میکنیم.
تخلیه صفراوی
از نظر تاریخی، تصور میشد که بیماران مبتلا به زردی در معرض خطر بیشتری برای عوارض حین عمل هستند، بنابراین تخلیه صفراوی اغلب قبل از پانکراتکتومی برای بهبود نتایج پس از عمل انجام میشد. از آن زمان، مطالعات متعددی نشان دادهاند که عوارض عفونی در بیمارانی که قبل از جراحی تخلیه صفراوی انجام میدهند، بیشتر رخ میدهد. در سال ۲۰۱۰، یک کارآزمایی تصادفی چند مرکزی از هلند نشان داد که میزان عوارض جدی حین عمل در بیمارانی که تحت عمل رفع فشار صفراوی با استنتهای صفراوی پلاستیکی قرار گرفتند، در مقایسه با بیمارانی که تحت عمل رفع فشار صفراوی قرار نگرفتند، بیشتر بود (۷۴٪ در مقابل ۳۹٪، P < ۰.۰۰۱). چند سال بعد، یک بررسی کاکرین تأیید کرد که تخلیه صفراوی قبل از عمل با میزان بالاتری از عوارض جانبی جدی همراه است. بنابراین، تخلیه صفراوی روتین برای بیماران مبتلا به سرطان پانکراس قابل برداشت، به طور معمول برای بیمارانی که تحت عمل جراحی de novo قرار میگیرند، توصیه نمیشود. در مقابل، تخلیه صفراوی یک سیستم صفراوی مسدود شده قبل از تجویز شیمی درمانی یا شیمی درمانی قبل از عمل اجباری است. در این سناریو، ما از استنتهای صفراوی فلزی کوتاه برای رفع فشار از درخت صفراوی استفاده میکنیم. ما دریافتهایم که در مقایسه با استنتهای پلاستیکی، استنتهای فلزی کوتاه مدت، مدت زمان باز بودن بیشتری دارند، به جلسات ERCP کمتری نیاز دارند و بدون افزایش عوارض حین عمل، دورههای کمتری از کلانژیت دارند. اخیراً، گروهی از هلند که کارآزمایی تصادفی چند مرکزی ذکر شده در بالا را انجام دادند، گروهی از بیمارانی را که تحت تخلیه صفراوی با استنت فلزی قرار گرفتند، با بیمارانی از این کارآزمایی که تحت تخلیه صفراوی با استنت پلاستیکی قرار گرفتند، مقایسه کردند و دریافتند که استنتهای فلزی میزان کمتری از عوارض مرتبط با PBD دارند (24٪ در مقابل 46٪، P = 0.01).
درمان جراحی
ملاحظات جراحی
اکثر تومورهای اولیه PDAC در غده پروگزیمال ایجاد میشوند و با جراحی پانکراتودئودنکتومی درمان میشوند. در مقابل، ضایعات دیستال با پانکراتکتومی دیستال درمان میشوند که معمولاً شامل اسپلنکتومی نیز میشود. به دلیل عوارض بالای مرتبط با این عمل و اثرات نامطلوب آن بر عملکرد غدد درونریز پانکراس، معمولاً از پانکراتکتومی کامل اجتناب میشود. رویکرد جراحی باید با هدف اصلی دستیابی به حاشیههای جراحی منفی از نظر میکروسکوپی (برداشتن R0) انتخاب شود.
پانکراتودئودنکتومی
بیمارانی که وضعیت عملکردی خوبی دارند و تومور اولیه آنها به طور بالقوه قابل برداشتن در رادیوگرافی است، واجد شرایط برداشتن هستند. اگر لاپاراسکوپی مرحلهبندی، بیماری خارج از پانکراس را نشان ندهد، جراح برشی در خط وسط یا زیر دندهای دو طرفه ایجاد میکند و کبد و صفاق را با دقت برای یافتن شواهدی از بیماری متاستاتیک مخفی در رادیوگرافی بررسی میکند. در MDACC، ما به طور معمول تجزیه و تحلیل frozen section حین عمل غدد لنفاوی منطقهای را انجام نمیدهیم. در عوض، تجزیه و تحلیل frozen section به صورت فردی انجام میشود. به عنوان مثال، تجزیه و تحلیل frozen section حین عمل غدد لنفاوی منطقهای یا خارج از منطقه (به عنوان مثال، غدد آئورتوکاوال) ممکن است در بیماران پرخطر (بیماران با سن بالا، بیماریهای همراه قابل توجه، سطح بالای سرم CA 19-9 و غیره) انجام شود. در چنین بیمارانی، یافتن بیماری متاستاتیک در غدد لنفاوی ناحیهای ممکن است نشان دهد که پانکراتودئودنکتومی، حتی در غیاب متاستازهای احشایی، توجیهپذیر نیست.
 |
| شکل 14.1 شش مرحله جراحی پانکراتیکودئودنکتومی استاندارد (برداشتن در جهت عقربههای ساعت). SMV، ورید مزانتریک فوقانی؛ SMA، شریان مزانتریک فوقانی. (از Tyler DS، Evans DB. پانکراتیکودئودنکتومی جراحی مجدد. Ann Surg 1994;219(2):211–221، با اجازه چاپ مجدد شده است.) |
برای کمک به سازماندهی یک عمل پیچیده، به حداقل رساندن زمان عمل و ارائه یک برنامه عملی واضح، پانکراتودئودنکتومی را به شش مرحله کاملاً مشخص تقسیم میکنیم (شکل 14.1).
1. کیسه کوچکتر از طریق صفحه بدون عروق بین امنتوم و مزوکولون/کولون عرضی وارد میشود، کولون راست متحرک میشود و صفاق احشایی به رباط تریتز تقسیم میشود که جمع شدن کولون راست و روده کوچک را تسهیل میکند. دوازدهه نمایان میشود. SMV زیر پانکراس با دنبال کردن مسیر تنه گاستروکولیک یا ورید کولیک میانی تا ریشه مزانتر شناسایی میشود.
2. مانور کوچر برای متحرک کردن دوازدهه و سر پانکراس تا سطح ورید کلیوی چپ انجام میشود.
3. تشریح پورتال برای نمایان کردن شریان کبدی هم در پروگزیمال و هم در دیستال نسبت به مبدا شریان گاسترودئودنال انجام میشود. سپس شریان گاسترودئودنال مسدود و تقسیم میشود. کیسه صفرا از کبد جدا میشود و مجرای کبدی مشترک درست از بالای محل اتصال آن به مجرای کیستیک قطع میشود. مجرای کبدی مشترک (PV) با تقسیم مجرای کبدی مشترک و انجام جمع کردن شریان کبدی مشترک به بالای آن نمایان میشود. در این مرحله، هرگونه آناتومی شریان کبدی متفاوت باید شناسایی شود تا از آسیب جلوگیری شود.
۴. اگر قرار است پیلور حفظ شود، دوازدهه ۱ تا ۲ سانتیمتر دورتر از پیلور قطع میشود تا یک کاف برای آناستوموز حفظ شود. در غیر این صورت، آنترکتومی استاندارد انجام میشود.
۵. ژژونوم تقریباً ۱۰ سانتیمتر دورتر از رباط تریتز قطع میشود. مزانترهای ژژونال و دوازدهه به ترتیب مسدود و تا سطح آئورت تقسیم میشوند. سپس دوازدهه و ژژونوم در زیر عروق مزانتریک چرخانده میشوند. ۶. پانکراس با استفاده از الکتروکوتر در سطح PV برش داده میشود. نمونه با بستن و تقسیم شاخههای کوچک وریدی به زائده آنسینات و سر پانکراس از SMV جدا میشود. SMA کاملاً نمایان میشود و وجه جانبی رگ در صفحه پریادونتیشیال تا مبدا آن در آئورت اسکلتبندی میشود. این مرحله برای دستیابی به حاشیه SMA منفی، که یکی از عوامل اصلی نتیجه خوب انکولوژیک است، بسیار مهم است. سپس نمونه از شکم خارج میشود.
 |
| شکل 14.2 چهار مرحله جراحی بازسازی خلاف جهت عقربههای ساعت پس از پانکراتیکودئودنکتومی استاندارد. (از Tyler DS, Evans DB. پانکراتیکودئودنکتومی جراحی مجدد. Ann Surg 1994;219(2):211–221، با اجازه چاپ مجدد شده است.) |
بازسازی به روشی مشابه، اما معکوس، گام به گام آغاز میشود (شکل 14.2). چهار مرحله بازسازی عبارتند از: (الف) پانکراتیکوژژنوستومی انتها به کنار؛ (ب) هپاتیکوژژنوستومی انتها به کنار؛ (ج) دئودنوژژنوستومی یا گاستروژژنوستومی انتها به کنار؛ و (د) قرار دادن لوله گاستروستومی، لوله ژژنوستومی و درنها طبق ترجیح جراح. در MDACC، ما به طور معمول لوله گاستروستومی قرار نمیدهیم و لولههای ژژنوستومی را برای بیمارانی که در معرض خطر بالای کمبود تغذیهای پس از جراحی هستند، رزرو میکنیم.
لنفادنکتومی
PDAC معمولاً از طریق مجاری لنفاوی خارج پانکراس به غدد لنفاوی منطقهای متاستاز میدهد و درگیری غدد لنفاوی یک عامل پیشآگهی غالب است. هدف اصلی لنفادنکتومی در زمان پانکراتکتومی، اطمینان از مرحلهبندی کافی است. اگرچه تعداد بیشتر غدد لنفاوی با نتایج بهتر مرتبط دانسته شده است، اما اثبات اینکه لنفادنکتومی گسترده به طور قابل توجهی بر بقا تأثیر میگذارد، با توجه به میزان بالای انتشار سیستمیک اولیه PDAC، دشوار بوده است. لنفادنکتومی در زمان پانکراتکتومی توسط آناتومی عروقی و احشایی هدایت میشود. حوضههای گرهای منطقهای که در یک پانکراتودئودنکتومی استاندارد گنجانده شدهاند، در امتداد مجرای صفراوی، شریان کبدی مشترک، PV، قوسهای شریانی پانکراتودئودنال، SMV و در امتداد دیواره جانبی SMA قرار دارند. مطالعات نقش لنفادنکتومی گسترده را ارزیابی کردهاند و در مقایسه با لنفادنکتومی “استاندارد” با وسعت کمتر، نتوانستهاند مزیتی برای بقا نشان دهند. با وجود این دادههای سطح بالا، در MDACC، لنفادنکتومی استاندارد که با پانکراتودئودنکتومی انجام میشود، شامل غدد لنفاوی (ایستگاههای عددی) است: قدامی و خلفی شریان کبدی مشترک (8a/p)، در امتداد شریان کبدی مناسب (12a1/2)، مجرای صفراوی مشترک و مجرای کبدی (12b1/2)، PV (12p1/2)، کیسه صفرا (12c)، سر پانکراس خلفی فوقانی و خلفی تحتانی (13a/b)، شریان مزانتریک فوقانی (14a/b) و سر پانکراس قدامی فوقانی و قدامی تحتانی (17a/b)، در حالی که پانکراتکتومی دیستال و اسپلنکتومی شامل ایستگاههای غدد لنفاوی در ناف طحال (10)، در امتداد شریان طحال (11p/d) و حاشیه فوقانی پانکراس (18) میشود.
برداشتن عروق مزانتریک
درگیری عروقی ناشی از سرطان، به ویژه درگیری SMV-PV، منع مطلقی برای پانکراتکتومی نیست. ما دریافتهایم که برداشتن و بازسازی محل تلاقی SMV-PV و شاخههای اصلی وریدی درجه یک در پانکراتودئودنکتومی هم ایمن است و هم با میزان بقای کلی مشابه بیمارانی که برای دستیابی به حاشیههای جراحی منفی نیازی به برداشتن وریدی ندارند، همراه است.
در MDACC، اکثر بیماران مبتلا به تومورهایی که در تصویربرداری مقطعی نشان داده میشوند که SMV یا PV را درگیر میکنند، شیمیدرمانی و/یا شیمیدرمانی قبل از عمل دریافت میکنند. برداشتن وریدی فقط باید برای دستیابی به حاشیه برداشت منفی انجام شود و نه به عنوان بخشی از پانکراتکتومی منطقهای یکپارچه.
تصویربرداری مقطعی میتواند نیاز به برداشتن عروقی را پیشبینی کند. از سوی دیگر، شواهدی برای تهاجم بافتشناسی ورید برای توجیه برداشتن وریدی لازم نیست. پانکراتیت و/یا فیبروز مرتبط با تومور یا درمان ممکن است نیاز به برداشتن وریدی داشته باشد، حتی اگر تهاجم واقعی به رگ وجود نداشته باشد. در مجموعه مقالات تران کائو و همکارانش، ۹۸ نفر از ۲۵۴ بیمار مبتلا به PDAC قابل برداشتن یا قابل برداشتن در مرز، تحت عمل برداشتن وریدی قرار گرفتند که در میان آنها تنها ۶۹٪ شواهد هیستوپاتولوژیک برای تهاجم وریدی داشتند.
استراتژی مورد استفاده برای بازسازی وریدی باید توسط آناتومی وریدی بیمار و محل و میزان درگیری وریدی تعیین شود. هدف جراحی حفظ جریان وریدی پورتال از معده، طحال و رودهها و در عین حال به حداقل رساندن خطر فشار خون بالای پورتال چپگرد است.
برخلاف برداشتن و بازسازی وریدی، برداشتن شریانی معمولاً در طول پانکراتودئودنکتومی توجیهپذیر نیست. یک استثنای قابل توجه زمانی است که تومور در امتداد شریان معده و دوازدهه گسترش یافته و شریان کبدی اصلی یا مشترک را درگیر کند، یا زمانی که شریان کبدی راست جایگزین شده یا شریان کبدی مشترک جایگزین شده ناشی از SMA توسط تومور درگیر شود. در چنین مواردی، ما معمولاً قبل از در نظر گرفتن برداشتن تومور، یک دوره طولانی درمان قبل از عمل را به بیماران ارائه میدهیم.
درمان کمکی (بعد از عمل) برای سرطان پانکراس برداشته شده
اولین مطالعه شیمیدرمانی کمکی در بیماران مبتلا به سرطان پانکراس برداشته شده توسط گروه مطالعات دستگاه گوارش انجام شد و در سال ۱۹۸۵ گزارش شد. بیمارانی که شیمیدرمانی مبتنی بر ۵-FU پس از عمل دریافت کردند، میانگین بقای کلی (۲۱.۰ ماه) به طور قابل توجهی طولانیتری نسبت به بیمارانی که فقط تحت عمل جراحی قرار گرفتند (۱۰.۹ ماه) داشتند، بنابراین ۵-FU به عنوان استاندارد برای شیمیدرمانی پس از عمل تعیین شد. با این حال، آزمایشهای بعدی که توسط سازمان اروپایی تحقیقات و درمان سرطان (EORTC) و گروه مطالعات اروپایی سرطان پانکراس (ESPAC) انجام شد، تأیید نکرد که شیمیدرمانی کمکی، مزیتی برای بقا دارد. در واقع، آزمایش ESPAC-1 نشان داد که شیمیدرمانی-پرتودرمانی در واقع مضر است.
مطالعه گروه انکولوژی پرتودرمانی 0848 در حال انجام است و بیماران را به صورت تصادفی به دو گروه دریافت کننده جمسیتابین کمکی یا جمسیتابین به همراه پرتودرمانی تقسیم میکند. این مطالعه باید به روشن شدن نقش درمان کمکی شیمیدرمانی-پرتودرمانی در بیماران مبتلا به سرطان پانکراس برداشته شده کمک کند. در سال 2008، Charite Onkologie و گروه انکولوژی پرتودرمانی نقش جمسیتابین کمکی را برای سرطان پانکراس برداشته شده ارزیابی کردند. کارآزمایی CONKO مشخص کرد که جمسیتابین کمکی با افزایش بقای بدون بیماری و بقای کلی (22.8 در مقابل 20.2 ماه، P = 0.005) نسبت به جراحی به تنهایی مرتبط است. کارآزمایی ESPAC-3، جمسیتابین کمکی را با 5-FU تزریقی مقایسه کرد و میانگین بقای مشابهی را نشان داد (23.6 در مقابل 23.0 ماه)، اما اشاره کرد که جمسیتابین عوارض جانبی جدی مرتبط با درمان کمتری دارد (7.5٪ در مقابل 14٪، P < 0.001).
جدیدترین کارآزمایی تصادفی، ESPAC-4، بیماران مبتلا به سرطان پانکراس برداشته شده را به صورت تصادفی به دو گروه تقسیم کرد: گروه اول جمسیتابین کمکی و گروه دوم کاپسیتابین یا گروه سوم مونوتراپی جمسیتابین دریافت کردند. میانگین بقای بیماران تحت درمان با جمسیتابین و کاپسیتابین بیشتر از گروه سوم جمسیتابین به تنهایی بود (28.0 در مقابل 25.5 ماه، P = 0.03) و هیچ تفاوت معنیداری در عوارض جانبی بین دو گروه وجود نداشت. تا به امروز، شواهد نشان میدهد که شیمیدرمانی کمکی، بقا را بهبود میبخشد و به نظر میرسد ترکیب جمسیتابین و کاپسیتابین موثرترین باشد. بر اساس شواهد موجود، انجمن انکولوژی بالینی آمریکا (ASCO) توصیه میکند که به همه بیماران مبتلا به سرطان پانکراس برداشته شده که درمان قبل از عمل را دریافت نکردهاند، 6 ماه درمان کمکی ارائه شود که ظرف 8 هفته پس از برداشتن جراحی آغاز میشود.
درمان قبل از عمل (نئوادجوانت)
تومورهای قابل برداشت
استدلال برای تجویز درمان قبل از عمل به بیماران مبتلا به سرطان پانکراس قابل برداشت با این واقعیت آغاز میشود که 80 تا 90 درصد از بیمارانی که تحت عمل جراحی برداشتن تومور قرار میگیرند، دچار عود بیماری میشوند.
علاوه بر این، تا 50 درصد از بیمارانی که تحت عمل جراحی برداشتن سرطان پانکراس قابل برداشت قرار میگیرند، در نهایت به دلایل مربوط به جراحی (یعنی عوارض یا اختلال تغذیهای) و/یا خود بیماری (یعنی پیشرفت بیماری) درمان کمکی بعد از عمل را دریافت نمیکنند.
انجام درمان قبل از عمل، بیماران را قادر میسازد تا بلافاصله درمان “کمکی” لازم را دریافت کنند و تضمین میکند که همه بیمارانی که تحت عمل جراحی برداشتن تومور قرار میگیرند، درمان سیستمیک دریافت کنند. درمان قبل از عمل همچنین انتخاب بیمارانی را برای جراحی که به احتمال زیاد از آن سود میبرند، تسهیل میکند.
بیمارانی که بیماری سیستمیک از نظر بالینی پنهان اما پیشرونده دارند، اغلب میتوانند در طول دوره درمان قبل از عمل شناسایی شوند و از عوارض احتمالی مرتبط با برداشتن لوزالمعده در امان بمانند.
تا به امروز، هیچ کارآزمایی تصادفی فاز III منتشر شدهای وجود ندارد که شیمیدرمانی سیستمیک نئوادجوانت را با شیمیدرمانی ادجوانت برای سرطان لوزالمعده قابل برداشتن مقایسه کرده باشد، اما برخی مطالعات فاز I/II وجود دارد که ایمنی شیمیدرمانی سیستمیک قبل از عمل را نشان میدهد و تأثیر درمانی آن را نشان میدهد. در سال 2007، پالمر و همکارانش یک کارآزمایی تصادفی فاز II را گزارش کردند که دو رژیم شیمیدرمانی نئوادجوانت (جمسیتابین در مقابل جمسیتابین/سیس پلاتین) را با هم مقایسه میکرد. هر دو رژیم به خوبی تحمل شدند و 54٪ از بیماران پس از اتمام شیمیدرمانی نئوادجوانت تحت عمل جراحی قرار گرفتند. میزان برداشت تومور R0 پس از شیمیدرمانی نئوادجوانت 75٪ بود، در حالی که این میزان برای جمعیت معاصر بیماران در همان موسسه که فقط با جراحی درمان شده بودند، 51٪ بود. میانگین بقای افرادی که تحت عمل جراحی قرار گرفتند، 28.4 ماه بود. در سال 2008، هنریچ و همکارانش یک کارآزمایی فاز II انجام دادند که شیمیدرمانی نئوادجوانت را با ترکیب جمسیتابین و سیس پلاتین ارزیابی میکرد.
بیست و چهار نفر از 28 بیمار در این کارآزمایی تحت عمل جراحی قرار گرفتند. شیمیدرمانی منجر به کاهش سطح CA 19-9 شد و پاسخ پاتولوژیک درجه I، II، III و IV به ترتیب در 46٪، 54٪، 0٪ و 0٪ مشاهده شد. میزان عوارض پس از جراحی با بیماران تاریخی تفاوتی نداشت و میانگین بقای 24 بیماری که تحت عمل جراحی قرار گرفتند، 26.5 ماه بود. اخیراً، ایلپو و همکارانش… یک کارآزمایی فاز II از جمسیتابین نئوادجوانت به همراه ناب-پاکلیتاکسل را در 25 بیمار مبتلا به سرطان پانکراس قابل برداشت و قابل برداشت در مرز سرطان منتشر کرد. 9 نفر از 17 بیماری که تحت عمل جراحی قرار گرفتند، در زمان تشخیص تومورهای قابل برداشت داشتند – هر 9 نفر تحت عمل جراحی برداشتن تومور (R0) قرار گرفتند و 7 نفر از 9 نفر پاسخ پاتولوژیک عمده داشتند. کارآزماییهای تصادفی فاز III که شیمیدرمانی نئوادجوانت را با برداشتن تومور با جراحی مقایسه میکنند، برای روشن شدن بیشتر نقش شیمیدرمانی نئوادجوانت برای بیماران مبتلا به سرطان پانکراس قابل برداشت مورد نیاز است. یکی از این کارآزماییها که در انتظار انتشار است، مطالعه NEOPAC است، یک کارآزمایی فاز III تصادفی چند مرکزی که جمسیتابین نئوادجوانت/اگزالپلاتین به همراه جمسیتابین کمکی را با جمسیتابین کمکی به تنهایی در بیماران مبتلا به سرطان پانکراس قابل برداشت مقایسه میکند.
MDACC سابقه طولانی در تجویز شیمیدرمانی نئوادجوانت برای PDAC قابل برداشت دارد. ایوانز و همکارانش یک کارآزمایی فاز II از شیمیدرمانی مبتنی بر جمسیتابین قبل از عمل (30 گری) انجام دادند؛ 24٪ از بیماران قبل از برداشتن جراحی، پیشرفت بیماری داشتند.
با این حال، میزان برداشت تومور با R0 در میان بیمارانی که تحت عمل پانکراتودئودنکتومی قرار گرفتند، بیش از 90٪ بود و میانگین بقای کل گروه و کسانی که تمام درمان برنامهریزی شده را تکمیل کردند، به ترتیب 23 و 34 ماه بود. در یک کارآزمایی فاز II که توسط Turrini و همکارانش انجام شد، بیماران قبل از جراحی، 5-FU و سیس پلاتین را به همراه 45 گری پرتودرمانی دریافت کردند. پیشرفت بیماری در 39٪ از بیماران قبل از عمل جراحی مشاهده شد. پاسخ پاتولوژیک کامل در 13٪ از بیمارانی که تحت عمل جراحی قرار گرفتند، مشاهده شد و در 92٪ از بیماران، برداشت تومور با R0 حاصل شد. دو کارآزمایی تصادفی اخیر توسط Golcher و همکارانش و Casadei و همکارانش برای مقایسه شیمیدرمانی و جراحی قبل از عمل با جراحی به تنهایی طراحی شده بودند، اما هر دو کارآزمایی به دلیل روند کند، زودتر از موعد بسته شدند.
این مطالعات دوباره نشان دادند که شیمیدرمانی قبل از عمل جراحی امکانپذیر و ایمن است. اگرچه نگرانیهایی در مورد ایمنی جراحی پانکراس پس از شیمیدرمانی مطرح شده است، ما اخیراً گروهی از بیماران مبتلا به PDAC را که تحت عمل پانکراتکتومی قرار گرفته بودند، چه به صورت de novo و چه پس از شیمیدرمانی قبل از عمل، بررسی کردیم و دریافتیم که شیمیدرمانی میزان عوارض یا مرگ و میر ۹۰ روزه را افزایش نمیدهد. در حال حاضر، چندین مطالعه فاز I/II در حال انجام است که نقش عوامل ایمونولوژیک و مهارکنندههای کیناز را در ترکیب با شیمیدرمانی ارزیابی میکنند، و همچنین برخی مطالعات در حال بررسی نقش روشهای جدید رادیوتراپی (پرتودرمانی با شدت تعدیلشده [IMRT] و پرتودرمانی استریوتاکتیک بدن) در بیماران مبتلا به سرطان پانکراس قابل برداشت هستند. کارآزمایی NEOPA یک مطالعه فاز III است که بیماران را به صورت تصادفی به دو گروه شیمیدرمانی نئوادجوانت مبتنی بر جمسیتابین (50.4 گری) در مقابل جراحی به تنهایی تقسیم میکند، که امیدواریم نقش شیمیدرمانی نئوادجوانت را در بیماران مبتلا به سرطان پانکراس قابل برداشت (BR) به طور واضحتری تعریف کند.
تومورهای قابل برداشت مرزی
MDACC استراتژیهای درمانی چند رشتهای را برای بیماران مبتلا به سرطان پانکراس قابل برداشت مرزی (BR) تعریف و توسعه داده است (جدول 14.1).
در سال 2008، کاتز و همکارانش تعریفی برای سرطان پانکراس BR بر اساس معیارهای دقیق تصویربرداری آناتومیک ارائه دادند، اما سایر عوامل بالینی را نیز در نظر گرفتند. بیماران به عنوان BR-A، BR-B یا BR-C طبقهبندی شدند، که در آن A به “آناتومی” تومور، B به معنای “زیستشناسی” سرطان و C به “وضعیت” یا وضعیت عملکرد بیمار اشاره دارد. تومورهای BR-A معیارهای تصویربرداری آناتومیک خاصی را برآورده میکنند (جدول 14.1). تومورهای BR-B یافتههای بالینی مشکوک به بیماریهای خارج پانکراسی مانند ضایعات کبدی نامشخص، آنتیژن کربوهیدرات سرم (CA) 19-9 ≥1000 واحد در میلیلیتر در شرایط بیلیروبین طبیعی، یا متاستاز به غدد لنفاوی منطقهای که با بیوپسی ثابت شده است، دارند. بیماران BR-C سن بالایی دارند (≥80 سال) یا بیماریهای همراه شدیدی دارند که نیاز به ارزیابی یا بهینهسازی گسترده دارند، یا وضعیت عملکردشان کاهش یافته است (ECOG ≥2).
در یک سری از 160 بیمار مبتلا به سرطان BR که از این طرح استفاده میکردند و با شیمیدرمانی قبل از عمل و/یا شیمیدرمانی و/یا پرتودرمانی درمان شدند، 41٪ از بیماران تحت عمل جراحی قرار گرفتند. میزان جراحی برای بیماران مبتلا به بیماری BR-A، BR-B و BR-C به ترتیب 38٪، 50٪ و 38٪ بود. میانگین بقای کلی برای کل گروه 18 ماه با بقای 5 ساله 18٪ بود. برای 66 بیماری که تمام درمانها را تکمیل کردند، میانگین بقای 40 ماه با بقای 5 ساله 36٪ بود. این دادههای آیندهنگر، پشتوانهای برای آزمایشهای بیشتر در مورد بررسی این رویکرد چندرشتهای فراهم کرد. اگرچه اظهارات اجماعی، تجویز هر دو روش شیمیدرمانی سیستمیک و شیمیدرمانی-پرتودرمانی را برای بیماران مبتلا به PDAC قابل برداشت در مرز، توصیه میکنند، اما بیشتر دادههای مورد استفاده برای پشتیبانی از این رویکرد، مبتنی بر دادههای مطالعات گذشتهنگر و تکمرکزی است.
کارآزمایی A021101 Alliance، که توسط Katz و همکارانش انجام شد، یک کارآزمایی آیندهنگر و چندمرکزی از این رویکرد بود. بیست و دو بیمار قبل از پانکراتکتومی، درمان را آغاز کردند که شامل FOLFIRINOX اصلاحشده (4 دوره) و شیمیدرمانی-پرتودرمانی (تابش خارجی 50.4-Gy و کاپسیتابین) بود. پانزده نفر از 22 بیمار (68٪) تحت عمل جراحی قرار گرفتند. ۱۲ مورد (۸۰٪) نیاز به برداشتن عروق داشتند، ۱۴ مورد (۹۳٪) حاشیههای میکروسکوپی منفی داشتند و ۵ مورد (۳۳٪) کمتر از ۵٪ سلولهای سرطانی باقیمانده داشتند. پس از موفقیت این کارآزمایی، یک کارآزمایی فاز II (Alliance A021501) برای تصادفیسازی بیماران مبتلا به سرطان پانکراس BR به FOLFIRINOX اصلاحشده (۸ سیکل)، جراحی و FOLFOX کمکی (۴ سیکل) یا FOLFIRINOX اصلاحشده (۷ سیکل)، پرتودرمانی کوتاهمدت، جراحی و FOLFOX کمکی (۴ سیکل) طراحی شد. این کارآزمایی و سایر کارآزماییها باید استراتژی درمانی بهینه را برای بیماران مبتلا به PDAC BR به طور واضحتری تعریف کنند.
نتایج جراحی
در سال ۲۰۰۶، وینتر و همکارانش تجربه جانز هاپکینز از ۱۴۲۳ عمل پانکراتودئودنکتومی برای سرطان پانکراس را از سال ۱۹۷۰ تا ۲۰۰۶ گزارش کردند. میزان مرگ و میر ناشی از عمل در دهههای ۱۹۷۰، ۱۹۸۰، ۱۹۹۰ و ۲۰۰۰ به ترتیب ۳۰٪، ۵٪، ۲٪ و ۱٪ بود.
چهل و دو درصد از بیماران، عمل جراحی برداشتن تومور با حاشیه مثبت داشتند. میانگین مدت زمان بقا در دهههای 1970، 1980، 1990 و 2000 به ترتیب 8، 14، 17 و 19 ماه بود. میزان بقای 5 ساله برای دهههای 1970، 1980، 1990 و 2000 نیز با گذشت زمان بهبود یافت – به ترتیب 5٪، 11٪، 18٪ و 20٪. شایان ذکر است که میانگین و میزان بقای 5 ساله برای دهههای 1990 و 2000 تفاوت معنیداری نداشت، که نشان میدهد حداکثر تأثیر جراحی بر بقا محقق شده است.
در سال 2009، کاتز و همکارانش، تجربه تجمعی MDACC از درمان جراحی بیماران مبتلا به سرطان لوزالمعده موضعی را منتشر کردند. سیصد و بیست و نه بیمار که بین سالهای ۱۹۹۰ تا ۲۰۰۲ تحت درمان قرار گرفته بودند، مورد ارزیابی قرار گرفتند. دویست و پنجاه و سه بیمار (۷۷٪) قبل از عمل، شیمیدرمانی و/یا شیمیدرمانی پرتودرمانی دریافت کردند. اکثر بیماران (۹۲٪) تحت عمل پانکراتودئودنکتومی قرار گرفتند. در مجموع ۱۰۸ بیمار (۳۳٪) تحت عمل برداشتن و بازسازی عروق قرار گرفتند. متاستاز غدد لنفاوی منطقهای در ۱۵۷ بیمار (۴۸٪) شناسایی شد و حاشیهها در ۵۲ بیمار (۱۶٪) از نظر میکروسکوپی مثبت بودند.
میانگین و بقای کلی ۵ ساله به ترتیب ۲۳.۹ ماه و ۲۷٪ بود. اخیراً، یک تجربه جامعتر ۲۵ ساله MDACC از درمان قبل از عمل و پانکراتودئودنکتومی منتشر شد که شامل ۶۲۲ بیمار بود. در طول این دوره زمانی، بخش بیشتری از بیمارانی که تحت عمل برداشتن قرار گرفتند، تومورهای قابل برداشت مرزی و پیشرفته موضعی داشتند. استفاده از شیمیدرمانی سیستمیک القایی و شیمیدرمانی کمکی پس از عمل با گذشت زمان افزایش یافت. میزان برداشتن تومور و برداشتن عروق در طول زمان افزایش یافته و در جدیدترین دوره زمانی به ترتیب ۹۴٪ و ۶۶٪ بوده است. در طول دوره زمانی ۲۵ ساله، میانگین بقای کلی از ۲۴ به ۴۳ ماه و بقای کلی ۵ ساله از ۲۳٪ به ۳۵٪ افزایش یافته است. این نتایج گواهی بر تکامل مراقبتهای چند رشتهای در زمینه پیشرفت در رژیمهای شیمیدرمانی، انتخاب بیماران جراحی و بهینهسازی درمان جراحی است. بهبود بیشتر در نتایج بیمار از بهبود درمان سیستمیک و توالی درمان حاصل خواهد شد.
نظارت بر انکولوژی پس از عمل
شواهد کمی برای هدایت فراوانی یا شدت استراتژیهای نظارت پس از برداشتن تومور بالقوه درمانی برای PDAC وجود دارد. تزنگ و همکارانش یک تجزیه و تحلیل هزینه-اثربخشی انجام دادند که عدم پیگیری را با فواصل ۳ یا ۶ ماهه با یا بدون آزمایش CA 19-9 و سیتیاسکنهای روتین مقایسه میکرد. ارزیابی بالینی هر 6 ماه یکبار با آزمایش CA 19-9 و بدون تصویربرداری، به نظر مقرون به صرفهترین استراتژی میرسید و در مقایسه با استراتژیهای نظارتی مکرر و شدیدتر، مزیت بقا مشابهی را ارائه میداد. ASCO توصیه میکند که به بیمارانی که درمان سرطان پانکراس بالقوه قابل درمان را تکمیل کردهاند، ویزیتهای پیگیری در فواصل 3 تا 6 ماهه ارائه شود، و اذعان میکند که شواهد کمی برای حمایت از این توصیه وجود دارد. با این وجود، ما معمولاً بیماران را هر 6 ماه یکبار در 2 سال اول پس از برداشتن بالقوه قابل درمان با سی تی اسکن شکم، عکس قفسه سینه و سطح CA 19-9 میبینیم. ویزیتها پس از 5 سال به سالانه تقسیم میشوند.
تومورهای پیشرفته موضعی
شیمی درمانی
کارآزمایی ACCORD-11/PRODIGE-4، یک کارآزمایی تصادفی فاز III، FOLFIRINOX را با جمسیتابین در بیماران مبتلا به سرطان پانکراس متاستاتیک مقایسه کرد و دریافت که FOLFIRINOX میزان پاسخ بالاتری با افزایش بقای بدون پیشرفت و کلی دارد. بر اساس اثربخشی FOLFIRINOX در بیماران مبتلا به بیماری متاستاتیک، استفاده از آن برای بیماران مبتلا به سرطان پانکراس پیشرفته موضعی (LA) نیز منطقی به نظر میرسید. مارتی و همکارانش یک مطالعه کوهورت آیندهنگر را گزارش کردند که در چندین موسسه در فرانسه انجام شد و FOLFIRINOX را به بیماران مبتلا به سرطان پانکراس پیشرفته موضعی تجویز کردند. سمیتهای درجه III-IV در 26٪ از بیماران رخ داد، اما تنها پنج بیمار به دلیل سمیت مجبور به قطع درمان شدند. طبق معیارهای RECIST، پیشرفت بیماری، بیماری پایدار و پاسخ نسبی به ترتیب در 16٪، 56٪ و 16٪ از بیماران مشاهده شد. هفتاد و پنج درصد از بیماران تحت درمان تثبیتی قرار گرفتند و در ۲۵ نفر از ۲۸ بیماری که تحت عمل جراحی قرار گرفتند، برداشتن تومور با موفقیت انجام شد.
میانگین بقای بدون پیشرفت و بقای کلی برای کل گروه به ترتیب ۱۳ و ۲۲ ماه بود که منجر به این نتیجه شد که جراحی نیز میتواند به صورت انتخابی پس از شیمیدرمانی در بیماران مبتلا به بیماری پیشرفته موضعی اعمال شود. در سال ۲۰۱۵، فرون و همکارانش مجموعهای گذشتهنگر از بیماران مبتلا به سرطان پانکراس (BR و LA) را که با FOLFIRINOX نئوادجوانت +/- شیمیدرمانی پرتودرمانی درمان شده بودند، ارائه کردند که بسیاری از آنها تصویربرداری قبل از عمل داشتند که معیارهای رادیوگرافی عدم قابلیت برداشت تومور را برآورده میکرد، اما توانستند تحت عمل جراحی برداشتن تومور با موفقیت (۹۲٪) قرار گیرند.
شیمیدرمانی-پرتودرمانی
LAP07 یک کارآزمایی بینالمللی فاز III بود که بیماران مبتلا به سرطان لوزالمعده لوزالمعده بدخیم (LA PDAC) را در صورت عدم وجود شواهدی از پیشرفت بیماری پس از 4 ماه مصرف جمسیتابین با یا بدون ارلوتینیب، به صورت تصادفی به دو گروه شیمیدرمانی یا شیمیدرمانی-پرتودرمانی تقسیم کرد.
پس از ۴ ماه شیمیدرمانی (جمسیتابین +/- ارلوتینیب)، ۲۶۹ نفر از ۴۴۲ بیمار هیچ نشانهای از پیشرفت بیماری نداشتند و به صورت تصادفی به دو گروه شیمیدرمانی-پرتودرمانی یا ۲ ماه دیگر از همان شیمیدرمانی تقسیم شدند. پرتودرمانی سهبعدی تطبیقی با دوز برنامهریزیشده کلی ۵۴ گری در ۳۰ جلسه طی ۶ هفته با کاپسیتابین همزمان استفاده شد. هیچ تفاوتی در بقای بدون پیشرفت (۹.۹ در مقابل ۸.۴ ماه) – یا بقای کلی (۱۵.۲ در مقابل ۱۶.۵ ماه) – بین بیمارانی که به ترتیب با شیمیدرمانی-پرتودرمانی یا شیمیدرمانی درمان شدند، وجود نداشت.
پیشرفت موضعی-منطقهای در گروه شیمیدرمانی-پرتودرمانی (۳۲٪) کمتر از گروه شیمیدرمانی (۴۶٪) رخ داد، در حالی که پیشرفت دوردست در بیماران تحت درمان با شیمیدرمانی-پرتودرمانی بیشتر از شیمیدرمانی (۶۰٪ در مقابل ۴۴٪) رخ داد. پرتودرمانی با دوز بالا نیز ممکن است در درمان بیماران مبتلا به بیماری پیشرفته نقش داشته باشد. کریشنان و همکارانش مجموعهای از ۲۰۰ بیمار MDACC متوالی با PDAC پیشرفته موضعی را گزارش کردند که شیمیدرمانی القایی (جمسیتابین یا فولفیرینوکس) را به مدت متوسط ۳.۵ ماه و به دنبال آن شیمیدرمانی و پرتودرمانی دریافت کردند. چهل و هفت بیمار با تومورهای غیرقابل جراحی > ۱ سانتیمتر از نزدیکترین مخاط دستگاه گوارش با IMRT با دوز افزایش یافته که دوز بیولوژیکی مؤثر (BED) > ۷۰ گری را ارائه میداد، تحت درمان قرار گرفتند. بیمارانی که BED > ۷۰ گری دریافت کردند، در مقایسه با کسانی که BED ≤۷۰ گری دریافت کردند، بقای بدون عود موضعی-منطقهای و بقای کلی بهتری داشتند.
درمانهای کاهنده
در طول سالها، چندین درمان کاهنده برای درمان سرطان پانکراس پیشرفته موضعی مورد بررسی قرار گرفته است. رادیوفرکانسی و مایکروویو از آسیب حرارتی برای از بین بردن سلولهای سرطانی استفاده میکنند، اما میتوانند به ساختارهای حیاتی در ناحیه اطراف مانند مجرای صفراوی یا عروق مزانتریک نیز آسیب برسانند و میزان عوارض 28 تا 40 درصد و میزان مرگ و میر 7.5 درصد را گزارش کردهاند.
الکتروپوریشن برگشتناپذیر (IRE) در سالهای اخیر مورد توجه فزایندهای قرار گرفته است. IRE از دو الکترود برای ارائه پالسهای الکتریکی استفاده میکند که دولایه لیپیدی دیواره سلولی را مختل میکند و منجر به آپوپتوز میشود، اما بر ساختار ماتریکس خارج سلولی تأثیر نمیگذارد. در سال 2015، پایلا و همکارانش یک مطالعه ایمنی و امکانسنجی آیندهنگر را در بیماران مبتلا به PDAC پیشرفته موضعی گزارش کردند. در همان سال، مارتین و همکارانش مجموعهای از 200 بیمار مبتلا به سرطان پانکراس پیشرفته موضعی را گزارش کردند که تنها با IRE (N = 150) یا همراه با رزکسیون جراحی (N = 50) درمان شدند. پنجاه و چهار نفر از ۱۵۰ بیماری که فقط تحت IRE قرار گرفتند، دچار عارضه شدند – ۳۲٪ از عوارض حداقل درجه III از نظر شدت بودند. میانگین بقای کلی پس از IRE به تنهایی ۱۸ ماه بود. مطالعه PANFIRE یک مطالعه فاز I/II بود که برای ارزیابی ایمنی و اثربخشی IRE هدایت شده توسط سیتیاسکن از راه پوست برای سرطان لوزالمعده پیشرفته موضعی طراحی شده بود، که میزان ۴۰٪ عوارض درجه III/IV را نشان داد. واضح است که درمان تخریبی برای LA PDAC با خطر قابل توجهی از عوارض شدید همراه است و تاکنون ثابت نشده است که از شیمیدرمانی سیستمیک یا استراتژیهای تلفیقی، مانند شیمیدرمانی با دوز بالا، مؤثرتر باشد.

بدون دیدگاه