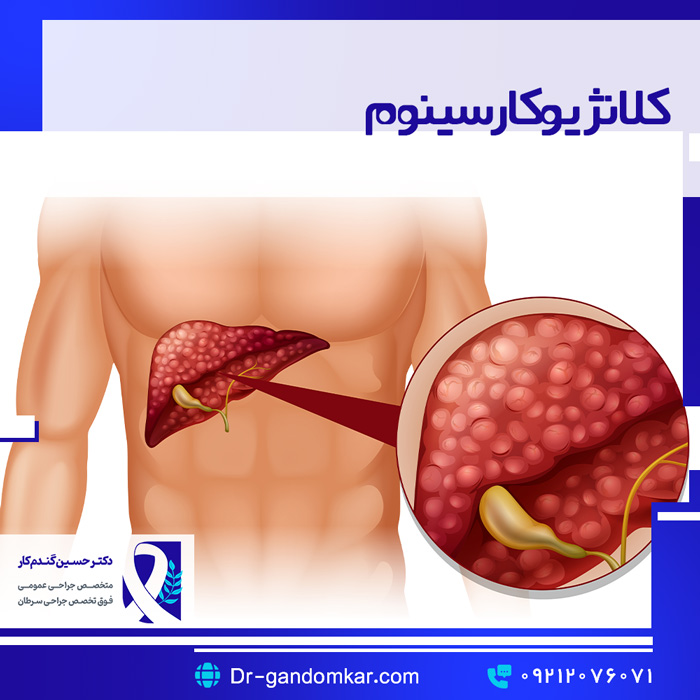
کلانژیوکارسینوم
کلانژیوکارسینوم داخل کبدی
کلانژیوکارسینومهای داخل کبدی (ICCA) از مجاری صفراوی داخل کبدی منشأ میگیرند و میتوانند بر اساس الگوهای رشدشان گروهبندی شوند، که میتوانند تشکیل توده (MF)، نفوذی به اطراف مجرا (PI) یا رشد در داخل مجاری (رشد داخل مجرا) باشند. نوع MF به صورت یک توده گرد در پارانشیم کبد ظاهر میشود و میتواند پس از برداشتن کبد در کبد باقی مانده عود کند. نوع PI از CCA داخل کبدی به صورت طولی در امتداد مجرای صفراوی رشد میکند و اغلب باعث انسداد یا تنگی میشود. پیامد بدتر با نفوذ تومور به سروز مجرای صفراوی، متاستاز به غدد لنفاوی و تهاجم عروقی و عصبی همراه است. ICCAها نسبت به کلانژیوکارسینومهای اطراف ناف (PCCA) تمایل بیشتری به متاستاز به غدد لنفاوی منطقهای دارند. به نظر میرسد میزان بروز این بیماری در ایالات متحده، حداقل تا حدی به دلیل افزایش شیوع استئاتوهپاتیت غیرالکلی، در حال افزایش است. با این حال، میزان بقای کلی همچنان پایین است و کمتر از 5 درصد بقای کلی 5 ساله را نشان میدهد و اطلاعات کمی در مورد پیامدهای مربوط به انواع خاص درمان وجود دارد.
در یک سری اخیر توسط یاماشیتا و همکارانش، از ۳۶۲ بیمار تحت درمان در مرکز سرطان مری اندرسون از سال ۱۹۹۷ تا ۲۰۱۵، ۱۶۰ بیمار در ابتدا کاندید جراحی، از جمله برداشتن تومور از جلو (۷۹ نفر) یا شیمیدرمانی نئوادجوانت و به دنبال آن برداشتن تومور (۴۳ نفر) در نظر گرفته شدند.
۳۸ بیمار دیگر نیز به دلیل یافتههای حین عمل یا پیشرفت در شیمیدرمانی قبل از عمل، بیماری غیرقابل جراحی داشتند. از ۲۰۲ بیمار باقیمانده با بیماری غیرقابل جراحی، اکثر آنها با شیمیدرمانی سیستمیک (N = ۱۱۶)، پرتودرمانی (N = ۸۱) یا مراقبتهای حمایتی (N = ۵) درمان شدند.
شایعترین علت مرگ، نارسایی کبدی ناشی از پیشرفت تومور موضعی بود. بیمارانی که با شیمیدرمانی قطعی درمان شدند، بیشتر در اثر نارسایی کبدی (N = ۷۱/۹۹، ۷۲٪) در مقایسه با بیمارانی که با رزکسیون (N = ۱۴/۴۷، ۳۰٪) یا پرتودرمانی (N = ۱۸/۴۴، ۴۱٪) درمان شدند، فوت کردند. در تجزیه و تحلیل چند متغیره، تنها پیشبینیکننده مستقل مرگ بدون نارسایی کبدی، درمان موضعی (رزکسیون یا پرتودرمانی) بود (OR ۴.۱۱ [۹۵٪ CI ۲.۱ تا ۸.۲]). بنابراین، ما برای به حداکثر رساندن کنترل بیماری داخل کبدی، درمانهای هدایتشده توسط کبد را برای تمام مراحل بیماری توصیه میکنیم. میزان بقا در این مطالعه با گذشت زمان در بین بیمارانی که با درمانهای موضعی درمان شدهاند، بهبود یافته است. اگرچه مقایسه نتایج بر اساس زمان درمان به دلیل سوگیری انتخاب دشوار است، اما به نظر میرسد برداشتن تومور بهترین پتانسیل را برای وضعیت طولانی مدت عاری از بیماری در بیماران مبتلا به ICC فراهم میکند.
کلانژیوکارسینومای پری هیلار
اپیدمیولوژی و علتشناسی
علتشناسی PCCA ناشناخته است. چندین بیماری با افزایش خطر همراه هستند، از جمله کلانژیت اسکلروزان، کولیت اولسراتیو، کیستهای کلدوک و بیماری کارولی (یک بیماری مادرزادی که با کیستهای صفراوی داخل کبدی متعدد مشخص میشود). عامل ایجاد کننده سرطان شایع در این شرایط مشخص نیست، اگرچه التهاب مزمن مجرای صفراوی احتمالاً نقش دارد.
ویژگیهای پاتولوژیک
آدنوکارسینوم شایعترین نوع بافتشناسی سرطان صفراوی است. از نظر مورفولوژیکی، PCCA را میتوان به صورت پاپیلاری (کمتر از 5٪ موارد)، ندولار (20٪) یا اسکلروزان (70٪) طبقهبندی کرد. بیشتر تومورهای پاپیلاری به خوبی تمایز یافته و با ضایعات متعدد در داخل مجرا بروز میکنند. تقریباً همه افرادی که مدت طولانی زنده میمانند، PCCA از نوع پاپیلاری دارند. برعکس، اکثر PCCA های نوع اسکلروزان تمایز کمی دارند و این نوع با پیشآگهی ضعیفی همراه است. توموری که در محل تلاقی مجاری کبدی راست و چپ ایجاد میشود، پس از توصیف ۱۳ ضایعه از این نوع توسط کلاتسکین در سال ۱۹۶۵، تومور کلاتسکین نامیده میشود. PCCA معمولاً طبق طبقهبندی بیسموت-کورلت طبقهبندی میشود. این طبقهبندی، گسترش طولی تومور را تعریف میکند و به تعیین استراتژی جراحی کمک میکند (شکل ۱۳.۸). تومورهای نوع I در زیر محل تلاقی مجاری کبدی چپ و راست بدون درگیری «سقف» محل تلاقی صفراوی قرار دارند. تومورهای نوع II مشابه تومورهای نوع I هستند اما تا سقف امتداد مییابند. ضایعات نوع III از طریق مجاری صفراوی داخل کبدی گسترش مییابند و فقط مجاری صفراوی درجه دو سمت راست (نوع IIIa) یا چپ (نوع IIIb) را درگیر میکنند و مجاری طرف مقابل را درگیر نمیکنند. تومورهای نوع IV به مجاری صفراوی درجه دو در هر دو سمت راست و چپ گسترش مییابند.
درمان بر اساس محل ضایعه تعیین میشود، زیرا کبدی که توسط تمام مجاری درگیر تخلیه میشود، برای درمان باید برداشته شود.
PCCAها رشد آهستهای دارند و اغلب از طریق گسترش مجاری صفراوی موضعی، متاستاز صفاقی یا متاستاز داخل کبدی گسترش مییابند.
متاستاز به غدد لنفاوی منطقهای کمتر اتفاق میافتد (30٪ تا 50٪ موارد) و گسترش اطراف عصبی نیز رخ میدهد. متاستازهای دوردست تقریباً در 25٪ تا 30٪ از بیماران در زمان تشخیص وجود دارند، اما گسترش هماتوژن نادر است. ضایعات یک سوم پروگزیمال و میانی مجرای صفراوی خارج کبدی میتوانند به شریان کبدی یا شریان کبدی زیرین فشرده، منقبض یا تهاجم کنند. علاوه بر این، تومورهای پروگزیمال میتوانند به پارانشیم کبد حمله کنند. تومورهای PCCA در ۳۶٪ از بیماران، پارانشیم لوب دمی را درگیر میکنند؛ ظهور آنها در این محل معمولاً از طریق گسترش صفراوی از طریق مجاری کوتاه دمی که به محل تلاقی صفراوی تخلیه میشوند، رخ میدهد، اگرچه ممکن است از توموری که در نزدیکی محل تلاقی صفراوی قرار دارد، منشأ بگیرند.
 |
| شکل ۱۳.۸ طبقهبندی تومورهای مجرای صفراوی خارج کبدی براساس سیستم بیسموت-کورلت، که الگوهای رایج CCA هیلار را در درخت صفراوی توصیف میکند. شکل استراتژی جراحی برای هر نوع تومور را نشان میدهد و زبانی را که برای توصیف چنین تومورهایی استفاده میشود، ارائه میدهد. انواع I، II و IIIa با هپاتکتومی راست گسترده درمان میشوند، در حالی که انواع I، II و IIIb با هپاتکتومی چپ یا هپاتکتومی چپ گسترده درمان میشوند. |
تظاهرات بالینی
شایعترین علائم ظاهری در بیماران مبتلا به PCCA عبارتند از: زردی انسدادی (که در 90٪ بیماران رخ میدهد) و خارش. به ندرت، یک تومور بسیار پروگزیمال ممکن است مجرای صفراوی سگمنتال یا لوبار را بدون ایجاد زردی مسدود کند. علائم دیگری که ممکن است رخ دهد عبارتند از: کاهش وزن (29٪ موارد)، درد مبهم شکم (20٪)، خستگی و حالت تهوع. بیمار همچنین ممکن است با کلانژیت و سپسیس ناشی از آلودگی باکتریایی مجرای صفراوی مسدود شده مراجعه کند. در صورت انسداد مجرای میانی یا دیستال، کیسه صفرای متورم ممکن است در معاینه شکم قابل لمس باشد. برعکس، PCCA هیلار معمولاً با کیسه صفرای غیرمتسع همراه است. بیماران مبتلا به PCCA علاوه بر افزایش بیلی روبین کل سرم، با افزایش آلکالین فسفاتاز و احتمالاً افزایش نشانگرهای تومور (آنتی ژن کربوهیدرات 19-9 [CA19-9] و CEA) نیز مراجعه میکنند.
تشخیص
اولین آزمایش رادیولوژیکی که باید در صورت شک به انسداد مجاری صفراوی خارج کبدی انجام شود، سونوگرافی است که میتواند اطلاعاتی در مورد سطح و ماهیت ضایعه مسدودکننده ارائه دهد. سونوگرافی همچنین میتواند اطلاعاتی در مورد مورفولوژی ضایعات، اتساع احتمالی مجاری صفراوی خارج کبدی و داخل کبدی، باز بودن شریان کبدی و وریدی، و وجود سنگ کیسه صفرا و اتساع کیسه صفرا ارائه دهد.
تصویربرداری بیشتر برای تعیین وسعت مقطعی و طولی (بین صفراوی) تومور ضروری است. در MD Anderson، سی تی اسکن چند فازی مارپیچی برش نازک در ترکیب با کلانژیوپانکراتوگرافی رتروگراد آندوسکوپی (ERCP) استفاده میشود. سی تی اسکن مارپیچی دارای دقت کلی 76٪ تا 100٪ و MRI دارای دقت کلی 89٪ برای مرحله بندی PCCA است. ما سیتیاسکن را ترجیح میدهیم زیرا امکان ارزیابی پوشش عروقی، ارزیابی مقطعی وسعت صفراوی تومور و ارزیابی بیماری متاستاتیک دوردست را در یک مطالعه واحد فراهم میکند.
در صورت عدم وجود بیماری دوردست، محل دقیق تومور و وسعت پروگزیمال و دیستال آن باید قبل از هرگونه مداخلهای مشخص شود. این اطلاعات را میتوان با استفاده از ERCP، کلانژیوپانکراتوگرافی رزونانس مغناطیسی (MRCP) یا کلانژیوگرافی ترانسهپاتیک از راه پوست (PTC) به دست آورد. هم ERCP و هم MRCP در حدود 40٪ موارد وسعت درگیری مجاری صفراوی را بیش از حد تخمین میزنند و هر دو روش تصویربرداری ممکن است نتوانند وسعت تومور داخل صفراوی را به صورت پروگزیمال تعیین کنند. اگر تصور شود که نقطه انسداد پروگزیمال به ناحیه پریهیلار است، PTC روش ترجیحی برای تعیین مجرای صفراوی است.
PTC همچنین امکان بیوپسی برس تومور، تخلیه خارجی مجاری صفراوی مسدود شده و قرار دادن استنت تسکینی را در صورت لزوم فراهم میکند. علیرغم بهبود تصویربرداری قبل از لاپاراتومی، ۲۵ تا ۴۰ درصد از بیماران در زمان جراحی بیماری غیرقابل جراحی دارند. DL در اکثر بیماران مبتلا به تومورهای بزرگ یا گسترده ناف ریه به دلیل فراوانی متاستاز در حفره صفاقی توصیه میشود.
برای PCCA قابل برداشت، گرفتن بافت برای تأیید تشخیص سرطان مجرای صفراوی ضروری نیست و اغلب دشوار است. در بیشتر موارد، تصمیم به عمل جراحی بر اساس یافتههای رادیولوژیک قبل از عمل است، نه تأیید بافتشناسی. حساسیت بیوپسیهای قلمموی ضعیف است (بسیار کمتر از ۵۰٪)، اگرچه تکنیکهای جدیدتر مانند FNA آندوسکوپیک هدایتشده توسط سونوگرافی از مجرای صفراوی ممکن است دقت تشخیصی را بهبود بخشد. درمان با یافتههای آناتومیک (مانند انسداد صفراوی، انسداد عروقی، آتروفی کبد) هدایت میشود.
مرحلهبندی و طبقهبندی آناتومیک
سیستم مرحلهبندی AJCC ویرایش هشتم، مرحلهبندی جداگانهای برای سرطانهای مجاری صفراوی خارج کبدی (ICCA)، سرطانهای مجاری صفراوی خارج کبدی (PCCA) و سرطانهای مجاری صفراوی خارج کبدی ارائه میدهد که در جداول ۱۳.۴ تا ۱۳.۶ ارائه شدهاند.
معیارهای برداشتپذیری
درمان قطعی برای همه سرطانهای مجاری صفراوی خارج کبدی، برداشت کامل تومور است. میزان برداشتپذیری کلی از ۱۰٪ تا ۸۵٪ متغیر است. ضایعات یک سوم پایینی مجرای صفراوی بهترین میزان برداشتپذیری را با پانکراتیکودئودنکتومی (که در فصل ۱۴ مورد بحث قرار گرفته است) دارند. انسدادهای یک سوم میانی مجرای صفراوی تقریباً همیشه به دلیل سرطان کیسه صفرا هستند که به طور جداگانه در نظر گرفته میشوند. برداشت تومورهای مجاری صفراوی خارج کبدی از نظر فنی چالش برانگیزتر است و به همین دلیل کمترین میزان برداشتپذیری را در بین تومورهای مجاری صفراوی دارند.
معیارهای استاندارد مورد استفاده برای تعیین برداشتپذیری مربوط به وسعت مجاری صفراوی و احاطه شدن عروق توسط تومور است. درگیری مجاری صفراوی ثانویه مستلزم برداشتن کبد در سمت درگیر است. درگیری عروقی شریان کبدی یا سرخرگ کبدی، برداشتن کبد از سمت آناتومیک درگیر را نیز ضروری میکند. با این حال، اگر مجاری صفراوی ثانویه در یک طرف درگیر باشند و انسداد عروقی در طرف مقابل رخ دهد، برداشتن کامل امکانپذیر نیست. درگیری غدد لنفاوی خارج از پایه کبدی (N2) و متاستازهای دوردست، مانع برداشتن میشوند.
CCA های داخل کبدی با برداشتن کبد با حاشیههای بدون تومور درمان میشوند. درمان جراحی PCCA مورد اختلاف نظرهای متعددی است که به طور خلاصه شرح داده میشوند: تخلیه صفراوی، وسعت برداشتن کبد و دم، و برداشتن PV (PVR).
عوامل دیگری در انتخاب بیماران برای برداشتن کبد، مانند وضعیت عملکرد بیمار، بین این بیماری و سایر بیماریها مشترک است و ارزیابی حجم FLR بخش اجباری درمان PCCA است زیرا اکثر بیماران نیاز به هپاتکتومی بزرگ یا طولانی با برداشتن مجرای صفراوی خارج کبدی دارند.
مطالعات موسسه ما و همچنین مطالعات بزرگترین سری بیماران در جهان (از ناگینو و نیمورا در ژاپن)، نشان میدهد که حجم FLR باید در نظر گرفته شود و از PVE برای افزایش حجم FLR قبل از هپاتکتومی طولانی برای PCCA ناف کبد استفاده شود. از آنجا که محل تلاقی مجاری صفراوی در پایه قطعه IV قرار دارد، این قطعه معمولاً باید صرف نظر از اینکه تومور مرکزی، چپ یا راست باشد، برداشته شود. برداشتن کبد معمولاً در سمت راست است که شامل هپاتکتومی طولانی سمت راست نیز میشود، زیرا 97٪ از تغییرات توصیف شده در آناتومی صفراوی شامل حفظ مجرای کبدی چپ طولانی است. بنابراین، بیماری ناف ریه که حتی کمی به سمت چپ یا به طور قابل توجهی به سمت راست گسترش یافته است، میتواند با استفاده از هپاتکتومی راست گسترده، با بهرهگیری از این مجرای طویل چپ، پاک شود. با این حال، مشکل این رویکرد، خطر بالاتر نارسایی کبد ثانویه به FLR ناکافی حتی پس از PVE است.
| جدول 13.4کمیسیون مشترک آمریکا در مورد مرحلهبندی سرطان سیستم سرطان مجرای صفراوی داخل کبدی، ویرایش هشتم |
 |
واضح است که بیماری در سمت چپ نیاز به هپاتکتومی چپ دارد که لزوماً شامل برداشتن قطعه IV یا هپاتکتومی گسترده چپ است. به طور کلی، به دست آوردن حاشیه منفی برای تومورهای بیسموت نوع IIIb که مجرای کبدی چپ را درگیر میکنند، به دلیل نیاز به بازسازی صفراوی با استفاده از مجرای کبدی کوتاه راست، دشوارتر است. علاوه بر این، شریان کبدی راست ممکن است در این سناریو درگیر شود و ممکن است نیاز به بازسازی شریانی داشته باشد. با این حال، ناگینو و همکارانش گزارش دادهاند که تعداد فزایندهای از هپاتکتومیهای گسترده چپ را انجام دادهاند که شامل 30٪ از کل تعداد هپاتکتومیها برای PCCA از سال 2006 تا 2010 است. علاوه بر این، گروه او بهبود در مرگ و میر کلی را نشان داده است (از 11.1٪ از 1977 تا 1990 به 1.4٪ از 2006 تا 2010). بر اساس این اصول، در ادامه چندین موضوع بحثبرانگیز را مورد بحث قرار میدهیم و توصیههای خود را ارائه میدهیم که به اصول آمادهسازی قبل از عمل بیمار و کبد برای جراحی نزدیک است.
| جدول 13.5کمیسیون مشترک آمریکا در مورد مرحلهبندی سرطان سیستم سرطان مجاری صفراوی پریهیلار، ویرایش هشتم |
 |
تخلیه صفراوی
نیاز به تخلیه صفراوی قبل از عمل به طور مفصل در مقالات علمی مورد بحث قرار گرفته است، اما اکثر آنها رفع زردی را به عنوان یک عنصر حیاتی در آمادهسازی بیمار و کبد برای هپاتکتومی ماژور میدانند. خود این روش بیخطر است و به نظر نمیرسد عوارض جراحی را افزایش دهد. در یک سری مطالعات ژاپنی توسط اباتا و همکارانش از ۱۶۰ بیمار مبتلا به PCCA، تخلیه صفراوی داخل کبدی از راه پوست در ۵۰ مورد از ۵۲ بیماری که تحت عمل ترکیبی کبد و PVR بدون عوارض قرار گرفتند، انجام شد.
در مرکز سرطان MD Anderson، ما به طور معمول کاتترهای تخلیه صفراوی قبل از عمل را برای تخلیه FLR قرار میدهیم. کبدی که قرار است برداشته شود معمولاً تخلیه نمیشود، مگر اینکه برای رفع زردی لازم باشد.
هیپربیلیروبینمی بازسازی کبد را مختل میکند و مقاومت در برابر عفونت سیستمیک را کاهش میدهد. برداشتن کبد در بیمار مبتلا به زردی با افزایش میزان مرگ و میر (36٪ در مقابل 16٪ برای افراد با بیلی روبین کمتر از 2 میلی گرم در دسی لیتر) و عوارض (50٪ در مقابل 15٪) همراه است. قرار دادن کاتترهای تخلیه صفراوی قبل از عمل همچنین شناسایی و تشریح مجرای صفراوی را در حین جراحی تسهیل می کند.
| جدول 13.6 کمیسیون مشترک آمریکا در مورد مرحلهبندی سرطان سیستم سرطان مجرای صفراوی دیستال، ویرایش هشتم |
 |
در مطالعهای روی ۱۳۳ بیمار مبتلا به کلانژیوکارسینومای ناف ریه که تحت هپاتکتومی ماژور قرار گرفتند، ریبرو و همکارانش میزان بالاتری از کلانژیت قبل از عمل را در بین بیمارانی که با درناژ صفراوی رتروگراد آندوسکوپیک تحت درمان قرار گرفتند، در مقایسه با درناژ ترانس کبدی از راه پوست، مشاهده کردند (۶۴٪ در مقابل ۱۳٪، P = ۰.۰۰۲). بنابراین، ما معمولاً درناژ از راه پوست را در شرایط قبل از عمل ترجیح میدهیم. در نهایت، میزان کلستاز در FLR نه تنها بر نیاز به درناژ صفراوی قبل از عمل تأثیر میگذارد، بلکه ممکن است بر آستانه پیگیری PVE نیز تأثیر بگذارد. در تجزیه و تحلیل چند متغیره، کلانژیت قبل از عمل (OR ۷.۵، P = ۰.۰۱۶) و حجم FLR کمتر از ۳۰٪ (OR ۷.۲، P = ۰.۰۱۹) مرگ مرتبط با نارسایی کبد پس از عمل را پیشبینی کردند. بنابراین، ما PVE را توصیه میکنیم تا FLR > ۳۰٪ در بین بیماران مبتلا به کلستاز تضمین شود.
وسعت برداشتن کبد
برداشتن CCA هیلار فقط زمانی باید انجام شود که حاشیههای جراحی منفی (R0) قابل دستیابی باشند. از نظر آناتومیکی، برداشتن کلانژیوکارسینوم هیلار باید به دو دلیل شامل لوب دمی در نظر گرفته شود. اول، تصویربرداری قبل از عمل، تخلیه دقیق دمی را به طور ناکافی تعریف میکند، که در بین جمعیت عمومی کاملاً متغیر است. دوم، مرز بین دمی خلفی و کبد راست یا چپ قدامی اغلب در حین عمل دشوار است. تلاش برای حفظ پارانشیم دمی ممکن است ناخواسته منجر به برداشتن ناقص تومور شود.
بررسی پاتولوژیک نمونههای برداشته شده تهاجم مستقیم تومور به پارانشیم کبد یا مجاری صفراوی لوب دمی را در 35٪ از بیماران نشان میدهد. علاوه بر این، لوب دمی اغلب محل عود تومور پس از برداشتن مجرای صفراوی است.
جارناگین و همکارانش مجموعهای از 80 بیمار را که تحت عمل جراحی CCA قرار گرفتند، گزارش کردند. میزان مرگ و میر ناشی از عمل و بقای 5 ساله به ترتیب 10٪ و 27٪ بود. با این حال، بقای 5 ساله پس از برداشتن شامل هپاتکتومی (28٪ با برداشتن دمی) 37٪ در مقابل 0٪ پس از برداشتن مجرای صفراوی بدون هپاتکتومی بود. اباتا و همکارانش بعداً مجموعهای از 160 بیمار را گزارش کردند که همگی تحت عمل برداشتن کبد با برداشتن دمی قرار گرفتند و علیرغم نیاز به برداشتن پورتال در 52/160 بیمار، مرگ و میر ناشی از عمل مشابه (10٪) و بقای 5 ساله (37٪) را گزارش کردند.
در مرکز سرطان MD Anderson، PCCA های نوع I و II با هپاتکتومی راست گسترده یا هپاتکتومی چپ (گسترده) همراه با برداشتن زائده دمی و دمی پاراکاوال درمان میشوند. PCCA های نوع IIIa با هپاتکتومی راست گسترده همراه با برداشتن زائده دمی و دمی پاراکاوال درمان میشوند. در صورت درگیری مجرا، لوب اشپیگل برداشته میشود. PCCA های نوع IIIb با هپاتکتومی چپ یا گسترده چپ، همراه با برداشتن کل کبد دمی درمان میشوند.
ضایعات نوع IV که قبلاً غیرقابل برداشت در نظر گرفته میشدند، اکنون به صورت انتخابی برای برداشتن در نظر گرفته میشوند. چندین مطالعه، OLT را به عنوان یک گزینه درمانی برای CCA به عنوان بخشی از یک رویکرد مبتنی بر پروتکل چندوجهی گزارش کردهاند. نتایج به طور مداوم ناامیدکننده بودهاند، با میزان عود بالای تومور و بقای کلی پایین (میزان بقای 5 ساله 23٪). توالی لاپاراتومی باز برای مرحلهبندی، شیمیدرمانی شدید و سپس OLT در درجه اول در کلینیک مایو (روچستر، مینه سوتا) بررسی شده است. تقریباً 80٪ از بیمارانی که معیارهای ورود دقیق را برآورده میکنند، در نهایت تحت پیوند قرار میگیرند. بقای 5 ساله برای همه بیماران پس از شروع درمان شیمیدرمانی 55٪ و برای بیمارانی که تحت پیوند قرار میگیرند 71٪ است. بیمارانی که وارد این پروتکل میشوند، نیازی به داشتن کلانژیوکارسینومای اثبات شده با بیوپسی ندارند. در عوض، معیارهای ورود برای سایر جایگزینهای رادیوگرافی و بیوشیمیایی نیز در نظر گرفته شده است. در نتیجه، این احتمال که بخشی از بیماران ممکن است قبل از شروع درمان نئوادجوانت و پیوند بعدی، به طور قطعی مبتلا به کلانژیوکارسینوما نبوده باشند، همچنان محتمل است.
ضایعات یک سوم پایینی مجرای صفراوی نیازی به برداشتن کبد ندارند، بلکه نیاز به پانکراتیکودئودنکتومی (روش ویپل) دارند. مجرای صفراوی پروگزیمال باید تا جایی برداشته شود که حاشیه جراحی برای تومور منفی باشد. گاهی اوقات، این ممکن است نیاز به برداشتن بیشتر مجاری صفراوی خارج کبدی با یک هپاتیکوژژنوستومی بالا داشته باشد. رویکرد جراحی برای پانکراتیکودئودنکتومی در مرکز سرطان MD Anderson در فصل 14 شرح داده شده است.
ضایعات یک سوم میانی مجرای صفراوی (که توسط آکیب و پیت تومورهای نوع 0 نامیده میشوند) بسیار نادر هستند. به دلیل نزدیکی این تومورها به شریان کبدی و PV، این ساختارها معمولاً درگیر میشوند.
هنگامی که یک تومور نوع 0 قابل برداشت تشخیص داده شود، بهتر است با برداشتن ناف ریه یا پانکراتیکودئودنکتومی درمان شود. از نظر بالینی، بیشتر انسدادهای مجرای میانی به دلیل سرطان کیسه صفرا هستند.
لنفادنکتومی منطقهای محدود معمولاً برای انسدادهای ناف ریه در طول برداشتن مجرای صفراوی خارج کبدی اندیکاسیون دارد تا امکان مرحلهبندی مناسب برای تعیین درمان مناسب پس از عمل و پیشآگهی فراهم شود.
برداشتن ورید پورتال
دو رویکرد کلی برای تهاجم PV در هنگام بررسی رزکسیون CCA هیلار وجود دارد. اگرچه برخی تهاجم پورتال را منعی برای رزکسیون میدانند، اما بقای طولانیمدت را میتوان با رزکسیون کامل، از جمله PVR، به دست آورد.
نویهاوس و همکارانش در آلمان یک رویکرد سیستماتیک برای PVR، “تکنیک بدون لمس” را پیشنهاد کردند. این رویکرد شامل PVR در تمام موارد CCA هیلار میشود. اگرچه میزان بقای 5 ساله بهتری با PVR (65٪) نسبت به بدون (0٪) به دست آمد، اما اکثر بیماران مبتلا به PVR تحت رزکسیون حاشیه منفی سمت راست قرار گرفتند (که همانطور که قبلاً توضیح داده شد، به دلیل مجرای طولانی چپ، حاشیه منفی تومور را ممکن میسازد). علاوه بر این، میزان مرگ و میر ناشی از عمل قابل توجه بود (17٪). رویکرد دوم توسط نیمورا و همکارانش پیشنهاد شد و توسط گروه آنها در گزارشی از اباتا و همکارانش بهروزرسانی شد. این گروه ارزیابی چسبندگی پورتال به ناحیه تومور در جراحی را توصیه کرد. آنها رویکرد انتخابی PVR خود (که در ۵۲/۱۶۰ بیمار استفاده شد) را با نشان دادن اینکه ۶۹٪ از افرادی که تحت PVR قرار گرفتند، شواهد میکروسکوپی از تهاجم تومور در PV برداشته شده داشتند، تأیید کردند. افرادی که در این سری از مطالعات PVR انجام ندادند، میزان بقای ۵ ساله بهتری (۳۷٪) نسبت به افرادی که انجام دادند (۱۰٪) داشتند، که به احتمال زیاد نشان دهنده تفاوت در زیست شناسی در این موارد است و از یک رویکرد انتخابی پشتیبانی میکند.
در مرکز سرطان MD Anderson، PV زمانی برداشته و بازسازی میشود که ورید از تومور جدا نشدنی باشد و زمانی که برداشتن ورید امکان برداشتن حاشیه منفی را فراهم کند. PVR روتین در موسسه ما انجام نمیشود.
نتایج جراحی
با وجود مدیریت جراحی تهاجمی، اکثر بیماران مبتلا به کارسینوم مجرای صفراوی تسلیم تومورهای خود میشوند. میزان بقا پس از برداشتن تومورهای مجرای صفراوی دیستال به طور کلی بهتر از میزان بقا پس از برداشتن CCA های هیلار بوده است. میزان بقای 5 ساله گزارش شده از 9 تا 18 درصد برای CCA های پروگزیمال و 20 تا 30 درصد برای ضایعات دیستال متغیر است. میانگین بقای بیماران بدون درگیری هیلار 18 تا 30 ماه است، اما در بیماران با درگیری هیلار تنها 12 تا 24 ماه است. عوامل پیشبینیکننده بقای طولانیمدت پس از برداشتن کبد برای CCA عبارتند از مرحله تومور T1، وضعیت غدد لنفاوی N0، بافتشناسی غیر تودهای و برداشتن R0. تهاجم عروقی، متاستاز غدد لنفاوی N2 و آتروفی لوبار همگی با پیامد نامطلوب مرتبط هستند. متاستاز غدد لنفاوی در 3 تا 53 درصد از بیماران یافت میشود. هیچ دادهای از لنفادنکتومی طولانی مدت پشتیبانی نمیکند. تسکین مطلوب برای بیماران مبتلا به تومورهای غیرقابل برداشت مشخص نیست.
اگر تومور قبل از بررسی غیرقابل برداشت تشخیص داده شده باشد، مجرای صفراوی را میتوان از طریق پوست یا آندوسکوپی تخلیه کرد. استفاده از استنتهای فلزی ثابت که از استنتهای سنتی بادوامتر هستند، این گزینه را جذابتر کرده است. تسکین ضایعات غیرقابل جراحی در محل تلاقی مجرای صفراوی، به ویژه ضایعات بیسموت نوع III و IV، میتواند به طور خاص دشوار باشد و معمولاً نیاز به استنتگذاری از طریق پوست دارد.
شیمی درمانی
هیچ عامل شیمی درمانی به طور قطعی در برابر CCA مؤثر نشان داده نشده است. آزمایشهای تک عاملی با استفاده از 5-FU میزان پاسخ کمتر از 15٪ را نشان دادهاند. سایر عوامل، مانند دوکسوروبیسین، میتومایسین C و سیس پلاتین، که به تنهایی یا در ترکیب با 5-FU استفاده میشوند، موفقیت بیشتری نداشتهاند.
کارآزمایی بین گروهی فاز II SWOG S0809، اثربخشی کاپسیتابین و جمسیتابین پس از عمل و به دنبال آن پرتودرمانی همزمان و کاپسیتابین را در بیماران مبتلا به کلانژیوکارسینوم خارج کبدی و سرطان کیسه صفرا ارزیابی کرد. در مجموع ۷۹ بیمار تحت درمان قرار گرفتند و ترکیب شیمیدرمانی و به دنبال آن شیمیدرمانی-پرتودرمانی عموماً به خوبی تحمل شد و سمیتهای درجه ۳ و ۴ به ترتیب در ۵۲٪ و ۱۱٪ از بیماران مشاهده شد.
یک کارآزمایی تصادفی چندملیتی فاز III (ACTICCA-1) در حال انجام، شیمیدرمانی کمکی با جمسیتابین و سیس پلاتین را در مقایسه با مشاهده پس از برداشتن سرطان کلانژیوکارسینوما و سرطان کیسه صفرا بررسی میکند. این مطالعه در سال ۲۰۱۴ آغاز شد و برای ارزیابی پیامد اولیه DFS به ۲۷۱ بیمار نیاز دارد.
پرتودرمانی
چندین مطالعه نقش پرتودرمانی کمکی را پس از برداشتن مجرای صفراوی بررسی کردهاند. دو مطالعه جداگانه از دانشگاه جان هاپکینز هیچ فایدهای از پرتودرمانی کمکی نیافتند. با این حال، کامادا و همکارانش نشان دادند که پرتودرمانی در بیمارانی که حاشیههای جراحی از نظر بافتشناسی برای بیماری مثبت هستند، مفید است. در MD Anderson، اگر آنالیز پاتولوژیک حاشیهها یا غدد لنفاوی مثبت یا تهاجم صفاقی را نشان دهد، بیماران همزمان با ۵۴ گری پرتودرمانی به بستر تومور، تزریق مداوم ۵-FU دریافت میکنند. بررسی انجام شده توسط Borghero و همکارانش روی ۶۵ بیمار که از سال ۱۹۸۴ تا ۲۰۰۵ تحت عمل جراحی برداشتن تومور CCA خارج کبدی در مرکز سرطان MD Anderson قرار گرفتند، بیمارانی را که در معرض خطر بالای عود موضعی-منطقهای (R1 و/یا pN1) بودند و شیمیدرمانی کمکی با ۵-FU یا کاپسیتابین (۴۲ نفر) دریافت کردند، با بیمارانی که در معرض خطر استاندارد (R0pN0) بودند و فقط با جراحی درمان شدند، مقایسه کرد.
عود موضعی-منطقهای پنج ساله و بقای کلی بین گروهها مشابه بود، که نشان میدهد شیمیدرمانی-پرتودرمانی کمکی ممکن است خطر عود موضعی-منطقهای را در بیماران پرخطر جبران کند.
پرتودرمانی همچنین در تسکین سرطانهای مجاری صفراوی غیرقابل جراحی مؤثر بوده است. دوزهای ۴۰ تا ۶۰ گری منجر به میانگین بقای ۱۲ ماهه و همچنین کاهش علائم شده است، احتمالاً به دلیل بهبود باز بودن استنت. درمان تسکینی فتودینامیک مجاری صفراوی نیز به عنوان یک گزینه درمانی تسکینی بالقوه در حال ظهور است.
سرطان کیسه صفرا
اپیدمیولوژی و علت شناسی
اگرچه سرطان کیسه صفرا نادر است، اما ششمین سرطان شایع دستگاه گوارش است. این تومور در همه گروههای سنی گزارش شده است، اما بیشتر در بیماران ۵۰ تا ۶۰ ساله رخ میدهد. تفاوت قابل توجهی در بروز تومور بین دو جنس وجود دارد: زنان سه تا چهار برابر مردان مبتلا میشوند. بررسی پایگاه داده SEER میزان بروز ۱.۲ مورد در هر ۱۰۰۰۰۰ نفر در سال را در ایالات متحده نشان میدهد. علت دقیق سرطان کیسه صفرا مشخص نیست؛ با این حال، با چندین بیماری مرتبط دانسته شده است. سنگ کیسه صفرا در 75٪ و 92٪ موارد سرطان کیسه صفرا وجود دارد. بیمارانی که سنگهای بزرگتر (با قطر بیش از 3 سانتیمتر) دارند، 10 برابر بیشتر از بیمارانی که سنگهای کوچک (کمتر از 1 سانتیمتر) دارند، در معرض خطر ابتلا به سرطان هستند. علاوه بر این، سرطان کیسه صفرا در 1٪ تا 2٪ از کل نمونههای کوله سیستکتومی یافت میشود، که این میزان چندین برابر بیشتر از میزان گزارش شده در مطالعات کالبدشکافی است. کوله سیستیت مزمن، از جمله مواردی که کیسه صفرا کلسیفیه شده است (“کیسه صفرای چینی”)، برخلاف آنچه قبلاً تصور میشد، با افزایش خطر ابتلا به سرطان همراه نیست. سایر عوامل مرتبط با سرطان کیسه صفرا شامل فیستولهای کوله سیستوئنتریک، محل اتصال غیرطبیعی پانکراس و صفرا، مواد سرطانزای شیمیایی، بیماری التهابی روده، استعداد خانوادگی، وضعیت ناقل مزمن سالمونلا و سندرم میریزی است.
ویژگیهای پاتولوژیک
آدنوکارسینوم کیسه صفرا توموری با رشد آهسته است که در 60٪ موارد از فوندوس (قسمت انتهایی روده کوچک) منشأ میگیرد. در معاینه ظاهری، کیسه صفرا سفت و با دیواره ضخیم به نظر میرسد. زیرگروه آدنوکارسینوم پاپیلاری (نوعی سرطان کیسه صفرا) به طور مشخص به صورت داخل مجرایی رشد میکند و به صورت داخل مجاری گسترش مییابد. این تومور کمتر تهاجمی است و در نتیجه، در مقایسه با سایر زیرگروههای بافتشناسی، پیشآگهی بهتری دارد. سرطان آدنواسکواموس بسیار نادر است و مانند آدنوکارسینوم درمان میشود.
سرطان کیسه صفرا از طریق متاستاز به غدد لنفاوی و تهاجم مستقیم به کبد مجاور گسترش مییابد. این بیماری میتواند پس از نشت صفرا به حفره صفاقی گسترش یابد و سلولها ممکن است در مسیرهای بیوپسی یا در محلهای پورت لاپاروسکوپی کاشته شوند. متاستاز غدد لنفاوی در 56٪ از کارسینومهای کیسه صفرای T2 یافت میشود و بیماری صفاقی در 79٪ از بیماران مبتلا به کارسینوم کیسه صفرای T4 یافت شده است. گره مجرای کیستیک، در محل تلاقی مجاری کیستیک و کبدی، محل اولیه معمول گسترش لنفاوی منطقهای است. تهاجم به کبد، چه از طریق گسترش مستقیم و چه از طریق رگهای تخلیه کننده که به بخشهای IV و V تخلیه میشوند، در بیش از 50٪ از بیماران مشاهده میشود. شایعترین محل متاستاز خارج شکمی دوردست، ریه است.
تظاهرات بالینی
در بیشتر موارد، درد شکم شایعترین علامت تظاهر است. تهوع، استفراغ، کاهش وزن و زردی از دیگر علائم شایع هستند. در معاینه فیزیکی، بیماران ممکن است درد ربع فوقانی راست شکم همراه با هپاتومگالی یا کیسه صفرای قابل لمس و متورم داشته باشند. نتایج آزمایشگاهی نکتهی قابل توجهی ندارند، مگر اینکه بیمار دچار زردی انسدادی شده باشد. نشانگرهای تومور CEA و CA19-9 ممکن است در بیماران مبتلا به سرطان کیسه صفرا افزایش یابند، اما نه حساس هستند و نه اختصاصی برای این بیماری.
تشخیص
هیچ آزمایش آزمایشگاهی یا رادیولوژیکی حساسیت ثابتی در تشخیص سرطان کیسه صفرا نشان نداده است. علاوه بر این، کمبود علائم و نشانههای بالینی، تشخیص قبل از عمل این سرطان را دشوار میکند.
این بیماری معمولاً یا به طور اتفاقی پس از کوله سیستکتومی یا در مرحلهی پیشرفته، هنگام بروز توده، زردی، آسیت یا بیماری صفاقی، تشخیص داده میشود. تشخیص صحیح قبل از عمل سرطان کیسه صفرا در کمتر از 10٪ موارد در اکثر سریها انجام میشود. در تجربهی پارک راسول، هیچ یک از 71 مورد گزارش شده قبل از عمل به درستی تشخیص داده نشدند. شایعترین تشخیصهای قبل از عمل، کوله سیستیت حاد یا مزمن و بدخیمیهای مجرای صفراوی یا پانکراس هستند. زردی همراه با تنگی مجرای صفراوی میانی چپ (نوع 0) تقریباً همیشه با سرطان کیسه صفرا مرتبط است. در مورد سرطان کیسه صفرا، سونوگرافی ممکن است ضخیم شدن غیرطبیعی دیواره کیسه صفرا یا وجود توده را نشان دهد. تصویربرداری بیشتر با سی تی اسکن یا ام آر آی با کنتراست به تعیین قابلیت برداشت و ارائه اطلاعات در مورد وسعت موضعی بیماری، از جمله PV یا تهاجم شریان کبدی، لنفادنوپاتی و متاستازهای دوردست کمک میکند.
مرحله بندی
سیستمهای مرحله بندی متعددی برای سرطان کیسه صفرا شرح داده شده است. سیستم مرحلهبندی اولیه، همانطور که نوین شرح داده است، بر اساس عمق تهاجم و گسترش تومور است.
سیستم مرحلهبندی AJCC برای سرطان کیسه صفرا اخیراً مورد بازنگری قرار گرفته است (جدول 13.7). مهمترین تغییر در سیستم مرحلهبندی AJCC این است که دیگر تمایزی بین تومورهای T3 و T4 بر اساس عمق تهاجم کبد وجود ندارد. در عوض، تومورهای T3 به عنوان تومورهایی تعریف میشوند که مستقیماً به کبد و/یا سایر اندامهای مجاور تهاجم میکنند و تومورهای T4 به عنوان تومورهایی تعریف میشوند که به PV، شریان کبدی یا چندین اندام یا ساختار خارج کبدی مجاور تهاجم میکنند.
لاپاروسکوپی نقش واضحی در مرحلهبندی قبل از لاپاراتومی سرطان کیسه صفرا دارد زیرا بیماری صفاقی در این سرطان شایع است. سرطان کیسه صفرا همچنین به صورت موضعی گسترش مییابد و به غدد لنفاوی موضعی-منطقهای (N1) و غدد لنفاوی اطراف پانکراس/آئورتوکاوال دور (N2) متاستاز میدهد و اغلب PV و شریان کبدی را در بر میگیرد و مانع از برداشتن جراحی میشود. دو مطالعه نشان دادند که لاپاراسکوپی میتواند از لاپاراتومی غیردرمانی در 33 تا 55 درصد از بیماران مبتلا به بیماری متاستاتیک جلوگیری کند. لاپاراسکوپی در تشخیص بیماری صفاقی در بیماران مبتلا به تومورهای پیشرفته موضعی دقیقتر از سیتیاسکن بود، که نشان میدهد بیماران مبتلا به ضایعات T3 و T4 ممکن است قبل از جراحی از DL بهرهمند شوند.
درمان جراحی
ویژگیهای استانداردی که تومور کیسه صفرا را غیرقابل جراحی میکنند عبارتند از (الف) وجود متاستازهای خونی یا لنفاوی دوردست؛ (ب) وجود ایمپلنتهای صفاقی؛ و (ج) تهاجم تومور به ساختارهای عروقی اصلی مانند شریانهای سلیاک یا مزانتریک فوقانی، ورید اجوف یا آئورت.
کارسینوم کیسه صفرا درجا (Tis) و کارسینوم محدود به مخاط (T1) را میتوان به تنهایی با کوله سیستکتومی به طور کافی درمان کرد، مشروط بر اینکه حاشیه مجرای کیستیک از نظر بیماری منفی باشد. این رویکرد میتواند میزان بقای 5 ساله را تا 100٪ افزایش دهد. وقتی قبل از جراحی به کارسینوم مشکوک باشیم، کوله سیستکتومی باز همراه با لنفادنکتومی هپاتودئودنال توصیه میشود زیرا مرحله T را نمیتوان در زمان جراحی به طور دقیق تعیین کرد و نشت صفرا یک عامل خطر مهم برای عود پریتون یا زخم است.
| جدول 13.7 کمیسیون مشترک آمریکا در مورد مرحلهبندی سرطان سیستم سرطان کیسه صفرا، ویرایش هشتم |
 |
شایعترین محل گسترش سرطان کیسه صفرا به غدد لنفاوی پریپورتال (LN) و سپس به غدد لنفاوی آئورتوکاوال است. غدد لنفاوی سلیاک نیز میتواند درگیر شود. بقای طولانیمدت برای بیمارانی که در شرایط مثبت بودن غدد لنفاوی خارج منطقهای (پارا آئورت، سلیاک یا SMA) (N2) تحت عمل جراحی رزکسیون قرار میگیرند، نشان داده نشده است. جدیدترین کنفرانس اجماع AHPBA/SSAT/SSO/ASCO بیانیهای اجماعی منتشر کرد که نمونهبرداری از غدد لنفاوی آئورتوکاوال را در شروع رزکسیون مورد نظر برای سرطان کیسه صفرا توصیه میکند. اگر این غدد لنفاوی در برش منجمد مثبت باشند، هیچ فایدهای برای ادامه رزکسیون رادیکال وجود ندارد. درمان جراحی برای تومورهای T2 تا حدودی بحثبرانگیز است. از آنجا که میزان شیوع گسترش غدد لنفاوی در مورد تومورهای T2 56٪ است، درمان جراحی بهینه برای این بیماران حداقل شامل یک کوله سیستکتومی طولانی است که شامل رزکسیون کل کیسه صفرا به همراه غدد لنفاوی پورتال میشود. یک بررسی بینالمللی اخیر توسط شیندو و همکارانش روی ۲۵۲ بیمار مبتلا به سرطان کیسه صفرای نوع T2 نشان داد که تومورهای سمت کبدی (T2h) میزان بالاتری از تهاجم عروقی، تهاجم عصبی و متاستاز غدد لنفاوی را نسبت به تومورهای سمت صفاقی (T2p) کیسه صفرا دارند (P <0.001). تومورهای T2h به طور مستقل با بقای کمتر در تجزیه و تحلیل چند متغیره (HR 2.7، [95% CI 1.7 تا 4.2]) و میزان بالاتر عود موضعی-منطقهای پس از برداشتن تومور همراه بودند.
بنابراین، در MD Anderson، ما کوله سیستکتومی طولانی مدت را توصیه میکنیم که شامل برداشتن کیسه صفرا به صورت بلوکی به همراه غدد لنفاوی پورتال و برداشتن گوهای یا آناتومیکی بستر کیسه صفرا (بخشهای IVb و V) برای همه تومورهای T2 باشد. تومورهای پیشرفته موضعی (T3 و T4) اغلب با متاستاز غدد لنفاوی (75٪ موارد) و متاستاز صفاقی (79٪) همراه هستند و اغلب با میزان بقای طولانی مدت (بیش از 5 سال) در محدوده 0٪ تا 5٪ همراه هستند. با این حال، مطالعات اخیر میزان بقای 5 ساله 21٪ تا 44٪ را برای مجموعهای از بیماران مبتلا به تومورهای T3 و T4 بدون بیماری متاستاتیک که تحت عمل جراحی رادیکال قرار گرفتهاند، گزارش کردهاند. میزان برداشتن کبد با میزان تهاجم تومور به حفره کیسه صفرا و درگیری تریاد پورتال راست تعیین میشود. برای دستیابی به حاشیه عاری از تومور، ممکن است هپاتکتومی راست، هپاتکتومی راست گسترده یا پانکراتیکودئودنکتومی لازم باشد. پانکراتیکودئودنکتومی معمولاً ضروری نیست مگر اینکه تومور به سر پانکراس گسترش یافته باشد. تومورهایی که شریان کبدی یا PV را درگیر میکنند، میتوانند به صورت یکجا برداشته شوند، اما چنین روش گستردهای به دلیل میزان بالای عوارض و مرگ و میر مرتبط، استاندارد محسوب نمیشود.
درمان چندوجهی
استفاده از عوامل شیمیدرمانی تکی و چندگانه، چه به عنوان درمان اولیه و چه به عنوان درمان کمکی، ناامیدکننده بوده است. میزان پاسخ سرطان کیسه صفرای پیشرفته موضعی به رژیمهای 5-FU تقریباً 12٪ است. 5-FU همراه با دوکسوروبیسین، میزان پاسخ 30٪ تا 40٪ را ایجاد کرده است. یک مطالعه ژاپنی در مورد داروی کمکی 5-FU و میتومایسین C، بهبود در بقای کلی 5 ساله را در بین بیماران مبتلا به سرطان کیسه صفرا که شیمیدرمانی دریافت کردهاند، نشان داد (26٪ در مقابل 14٪؛ P = 0.037)، با این حال، این رژیم به طور معمول در ایالات متحده اجرا نشده است. همانطور که قبلاً ذکر شد، کارآزمایی بین گروهی فاز II SWOG S0809 ایمنی و اثربخشی کاپسیتابین و جمسیتابین پس از عمل و به دنبال آن پرتودرمانی همزمان و کاپسیتابین را در بیماران مبتلا به کلانژیوکارسینوم خارج کبدی و سرطان کیسه صفرا نشان داد.
پرتودرمانی در شرایط کمکی پس از عمل، نویدبخش بوده است، اگرچه اکثر سریها کوچک بودهاند. پرتودرمانی با پرتو خارجی با دوز ۴۵ گری میتواند اندازه تومور را در ۲۰ تا ۷۰ درصد موارد کاهش دهد و زردی را در تا ۸۰ درصد بیماران تسکین دهد. در مرکز سرطان MD Anderson، بیماران مبتلا به سرطان کیسه صفرا پس از عمل با ترکیبی از شیمیدرمانی با تزریق مداوم جمسیتابین و سیس پلاتین با رویکردی مشابه آنچه در بیماران مبتلا به CCA استفاده میشود، درمان میشوند.
نتیجهگیری
پیشرفتهای زیادی در درمان جراحی بیماریهای کبد حاصل شده است. پیشرفت در تصویربرداری، انتخاب بیمار و آمادهسازی بیمار برای هپاتکتومی ماژور، به بقای طولانیتر و بهتر بیمارانی که تحت عمل جراحی قرار میگیرند، منجر شده است. به طور خاص، توجه دقیق به اندازهگیری حجم کبد قبل از برداشتن عمده در بیماران مبتلا به بیماری کبدی و برداشتن گسترده در بیماران با کبد طبیعی، با استفاده از تکنیکهایی مانند PVE، عوارض بسیار کمتر و مرگ و میر بسیار کمی را برای جراحی کبد فراهم کرده است. برای HCC، طیف درمانها منعکس کننده طیف بیماری و/یا مجموعه بیماری زمینهای کبد است. درمانها طیف گستردهای دارند، از جمله برداشتن کبد، OLT، ابلیشن تومور، آمبولیزاسیون از طریق شریان، آمبولیزاسیون Y90 و پرتودرمانی خارجی یا پروتون درمانی. برای این بیماری، درمان سیستمیک نقش نسبتاً کمی در گروه بسیار منتخب بیماران دارد.
برای بیماران مبتلا به سرطان کبد (CRLM)، معیارهای برداشتن تومور گسترش یافته و شامل تومورهای بزرگتر، متعدد و دو طرفه نیز میشود. با وجود این موارد، بقای بیماران همچنان در حال بهبود است. علاوه بر این، شیمیدرمانی مؤثر که به سرعت در حال تکامل است، جمعیت بیماران واجد شرایط برای درمان قطعی جراحی را افزایش میدهد. درک ویژگیهای خاص تومور مربوط به وضعیت جهش، مانند KRAS، احتمالاً منجر به تنظیم فردی درمان سیستمیک و جراحی در آینده خواهد شد.
متأسفانه، این مزایای درمان کمکی به بیماران مبتلا به سرطان مجاری صفراوی تعمیم داده نشده است. اگرچه گروه کوچکی از بیماران مبتلا به سرطان کیسه صفرا و کارسینوم کیسه صفرا از برداشتن عمده کبد سود میبرند، اما اکثر بیماران با بیماری غیرقابل برداشت مراجعه میکنند و با وجود پیشرفتهای درمانی در سایر زمینهها، با گزینههای درمانی محدودی روبرو هستند.
به طور خلاصه، رویکرد چند رشتهای به بیماران مبتلا به تومورهای کبدی نیاز به مشارکت متخصصان جراحی کبد و صفراوی؛ انکولوژی جراحی، پزشکی و پرتودرمانی؛ گوارش و رادیولوژی دارد تا درمان بهینه امروز و پیشرفت درمان چندوجهی در آینده را ممکن سازد.


بدون دیدگاه