چه چیزهایی در ویرایش ششم جدید است؟
چشمانداز درمان ملانوما در چند سال گذشته با سرعت زیادی تکامل یافته است؛ نکته مهم این است که توسعه و تأیید بعدی درمانهای هدفمند، ایمنی و داخل ضایعهای توسط سازمان غذا و داروی ایالات متحده (FDA)، گزینههای درمانی را برای بسیاری از بیماران مبتلا به بیماری پیشرفته به طور قابل توجهی گسترش داده است. با توجه به تکامل مداوم و سریع این چشمانداز درمانی، مهم است که جراحان انکولوژی از این پیشرفتها مطلع باشند. در این فصل، ما مقدمهای بر مراقبت چند رشتهای از بیماران مبتلا به ملانوما در طیف این بیماری ارائه میدهیم و همچنین سیستم مرحلهبندی ملانوما کمیته مشترک سرطان آمریکا (AJCC) که اخیراً در ویرایش هشتم منتشر شده است را معرفی میکنیم که قرار است به طور رسمی برای گزارش ملی در ژانویه 2018 پذیرفته شود.
اپیدمیولوژی
شیوع ملانومای تهاجمی پوستی همچنان یک نگرانی عمده بهداشت عمومی در ایالات متحده است. نکته نگرانکننده این است که میزان ملانوما در چند دهه گذشته در ایالات متحده حدود 3 درصد در سال افزایش یافته است. تخمین زده میشود که در سال ۲۰۱۷، ۸۷۱۱۰ مورد ملانوم تهاجمی در ایالات متحده تشخیص داده شود و تقریباً ۹۷۳۰ بیمار بر اثر این بیماری جان خود را از دست خواهند داد. ملانوما همچنان در سفیدپوستان بیش از ۲۰ برابر بیشتر از آمریکاییهای آفریقاییتبار شایع است. به طور کلی، خطر ابتلا به ملانوما در طول زندگی برای سفیدپوستان حدود ۲.۵٪ (۱ در ۴۰) برای سیاهپوستان ۰.۱٪ (۱ در ۱۰۰۰) و برای اسپانیاییتبارها ۰.۵٪ (۱ در ۲۰۰) است. میزان بروز ملانوما در ۳۰ سال گذشته سریعتر از تقریباً هر سرطان دیگری افزایش یافته است. عامل خطر اصلی محیطی، قرار گرفتن در معرض اشعه ماوراء بنفش (UV)، در الگوهای جغرافیایی و قومی میزان ملانوما منعکس شده است. همچنین تغییراتی در توزیع و مرحله ملانوما در زمان تشخیص وجود داشته است، به طوری که روند کلی به سمت تومورهای نازکتر، به ویژه در بین بیماران مبتلا به ملانومهای T1/T2، بوده است، در حالی که روند معکوس در بین بیماران مبتلا به ضایعات ضخیم T4 مشاهده میشود.
عوامل خطر
شناسایی عوامل خطر و تخمین خطر ابتلا به ملانوما در فرد میتواند از نظر بالینی در تعیین استراتژیهای پیشگیری اولیه و هدایت سطح غربالگری مفید باشد. بیمارانی که به عنوان در معرض خطر بالای ملانوما شناسایی شدهاند، ممکن است در آزمایشهای پیشگیری نیز شرکت داده شوند. عوامل متعددی میتوانند یک بیمار را در معرض خطر ابتلا به ملانوما قرار دهند. برخی از عوامل قابل اصلاح هستند در حالی که برخی دیگر ذاتی فرد هستند.
- نوع پوست: میزان ابتلا به ملانوما در سفیدپوستان حداقل 20 برابر آمریکاییهای آفریقاییتبار و پنج برابر اسپانیاییتبارهای آمریکایی است. علاوه بر این، بیماران سفیدپوست با موهای قرمز یا بور، رنگ پوست روشن یا چشمهای آبی در معرض خطر بیشتری برای ابتلا به ملانوما هستند.
- سن و جنسیت: میزان بروز ملانوما با افزایش سن افزایش مییابد. میزان بروز ملانوما در زنان قبل از ۴۹ سالگی ۱.۷ برابر بیشتر از مردان است. در سنین بالای ۷۰ سال، میزان بروز ملانوما در مردان ۲.۴ برابر بیشتر از زنان است. به طور کلی، میزان بروز ملانوما در مردان بیشتر از زنان است. به طور خاص، خطر ابتلا به ملانوما در طول عمر یک مرد تقریباً ۱.۵ برابر بیشتر از خطر ابتلا به ملانوما در زنان است.
- قرار گرفتن بیش از حد در معرض اشعه ماوراء بنفش (UVR) خورشید: قرار گرفتن بیش از حد در معرض اشعه ماوراء بنفش خورشید با افزایش خطر ابتلا به ملانوما مرتبط بوده است. دادههای توالی ژنتیکی نیز از نقش ملانوماژنز UV پشتیبانی میکنند. ملانوما که به عنوان توموری با یکی از بالاترین بارهای جهشی شناخته میشود، یک گزارش مهم از تلاش ملانوما در برنامه اطلس ژنوم سرطان نشان داد که اکثر جهشهای سوماتیک در ملانوما در واقع دارای “نشانه UV” هستند. دادهها نشان میدهند که آسیب ناشی از آفتابسوختگی در دوران کودکی یا حتی بزرگسالی با افزایش خطر ابتلا به ملانوما مرتبط است. همبستگی بین تعداد دفعات آفتابسوختگی شدید و دردناک و خطر ابتلا به ملانوما شناسایی شده است؛ به عنوان مثال، بیمارانی که سابقه بیش از 10 مورد آفتابسوختگی شدید دارند، در مقایسه با بیمارانی که سابقه آفتابسوختگی ندارند، بیش از دو برابر بیشتر در معرض ابتلا به ملانوما هستند.
- استفاده از دستگاههای برنزه کننده خانگی: مطالعات متعدد نشان میدهد که استفاده از دستگاه برنزه کننده خانگی نیز به شدت با افزایش خطر ابتلا به ملانوما مرتبط است. یک بررسی سیستماتیک توسط آژانس بینالمللی تحقیقات سرطان (IARC) افزایش 15 درصدی خطر نسبی ابتلا به ملانوما را در افرادی که تا به حال از سولاریوم استفاده کردهاند در مقایسه با افرادی که هرگز از آن استفاده نکردهاند، نشان داده است (RR 1.15؛ 95% CU 1.00 تا 1.31)؛ خطرات برنزه کردن خانگی توسط گروههای بعدی آمریکایی و استرالیایی تأیید شده است. شروع در سنین پایین و دفعات بیشتر استفاده از دستگاههای برنزه کننده، از عوامل خطر کلیدی هستند که با خطر بیشتر ابتلا به ملانوما مرتبط هستند. در واقع، یک مطالعه مورد-شاهدی خوب طراحی شده در مینه سوتا، افزایش خطر را با تعداد سالها، ساعات و جلسات برنزه کردن در فضای بسته، مستقل از قرار گرفتن در معرض آفتاب در فضای باز، نشان داد. این محققان همچنین دریافتند که ۹۷٪ از زنانی که قبل از ۳۰ سالگی به ملانوما مبتلا شدهاند، برنزه شده در فضای بسته بودهاند.یک مطالعه مبتنی بر جمعیت استرالیایی نشان داد که استفاده از تختهای برنزه بیش از 10 بار در سال با دو برابر شدن خطر ابتلا به ملانوما در بیماران حداقل 30 سال سن مرتبط است و این ارتباط با قرار گرفتن زودتر در معرض آن قویتر است. بیماران جوانی که سالانه بیش از 10 بار از دستگاههای برنزه کننده خانگی استفاده میکنند، در مقایسه با افرادی که برنزه خانگی نمیکنند، بیش از 7 برابر بیشتر در معرض خطر ابتلا به ملانوما هستند. یک متاآنالیز اخیر تخمین زده است که برای هر جلسه برنزه کردن اضافی، 1.8 درصد خطر ابتلا به ملانوما افزایش مییابد. از سال 2009، سازمان بهداشت جهانی تختهای برنزه کننده را به عنوان یک ماده سرطانزای کلاس I فهرست کرده است.
- ملانوما قبلی: افرادی که سابقه شخصی ملانوما دارند، خطر ابتلا به ملانوما دوم را تقریباً 3 تا 7 درصد افزایش میدهند.
- خالهای خوشخیم: اگرچه یک خال خوشخیم به احتمال زیاد پیشساز ملانوما نیست، اما وجود تعداد زیادی خال به طور مداوم با افزایش خطر ابتلا به ملانوما مرتبط بوده است. افرادی که بیش از ۵۰ خال دارند و قطر همه آنها بیش از ۲ میلیمتر است، ۵ تا ۱۷ برابر بیشتر از افرادی که خالهای کمتری دارند، در معرض خطر ابتلا به ملانوما قرار دارند. افرادی که مستعد ابتلا به کک و مک هستند نیز در معرض خطر بیشتری برای ابتلا به ملانوما هستند.
- سابقه خانوادگی: تقریباً ۱۰٪ از افراد مبتلا به ملانوما، یکی از اعضای خانواده آنها سابقه ملانوما داشته است. سابقه خانوادگی ملانوما، خطر ابتلا به ملانوما را در فرد سه تا هشت برابر افزایش میدهد. علاوه بر این، افرادی که دو یا چند عضو خانواده آنها مبتلا به ملانوما هستند نیز در معرض خطر بسیار بالایی قرار دارند.
- استعداد ژنتیکی: تقریباً ۸٪ تا ۱۲٪ از ملانوماها در افرادی با استعداد ژنتیکی رخ میدهد. تغییرات ژنتیکی خاصی در پاتوژنز ملانوما نقش دارند. مهارکننده کیناز وابسته به سیکلین ۲A (CDKN2A) شایعترین جهش شناسایی شده در ملانوما خانوادگی مشکوک است. یک ژن سرکوبگر تومور که روی کروموزوم 9p21 قرار دارد، CDKN2A، احتمالاً در ملانوم پوستی خانوادگی و پراکنده نقش دارد. دادههای آمریکای شمالی، اروپا و استرالیا، جهش CDKN2A در سلولهای زایا (به ترتیب 45٪، 57٪ و 20٪) را با خانوادههای دارای موارد متعدد، سن شروع بیماری و موارد اولیه متعدد در یک بیمار مرتبط میدانند. حذف یا بازآرایی کروموزومهای 10 و 8p نیز در ملانوم پوستی به خوبی مستند شده است. همچنین افزایش تعداد کپی کروموزومهای 2، 6p، 7، 8، 17، 19 و 20 با افزایش بروز ملانوما مرتبط است.
این ملانوماها همچنین تمایل دارند در سنین پایینتر بروز کنند و افراد ممکن است ضایعات اولیه متعددی داشته باشند. ۹. سندرم خال و ملانوم آتیپیک: سندرم خال و ملانوم آتیپیک که قبلاً با نام سندرم خال دیسپلاستیک شناخته میشد، با وجود خالهای دیسپلاستیک آتیپیک متعدد، بزرگ (>۵ میلیمتر) معمولاً در نواحی غیر در معرض پوست مشخص میشود که نشاندهنده یک نوع کلینیکوپاتولوژیک متمایز از ضایعه ملانوسیتی هستند. ملانوماها میتوانند از پوست طبیعی یا از یک خال دیسپلاستیک منشأ بگیرند. از آنجایی که فراوانی واقعی پیشرفت یک خال آتیپیک به ملانوما کم است، برداشتن تمام خالهای دیسپلاستیک توصیه نمیشود. با این حال، ضایعات جدید، در حال تغییر یا علامتدار که در معاینه بالینی و/یا درموسکوپی مشکوک به ملانوما به نظر میرسند، باید از نظر بافتشناسی ارزیابی شوند.
تظاهرات بالینی
ویژگیهای بالینی ملانوما اغلب شامل رنگهای متنوع، سطح برجسته نامنظم، محیط نامنظم و زخم سطحی است. باید از ضایعه رنگدانهای که از نظر اندازه، شکل یا رنگ تغییر میکند، بیوپسی انجام شود. به اصطلاح ABCDEها ابزاری برای یادآوری علائم اولیه بالقوه ملانوما هستند. A نشاندهنده عدم تقارن ضایعه، B نشاندهنده بینظمی حاشیه، C نشاندهنده تنوع رنگ، D نشاندهنده قطر بزرگتر از 6 میلیمتر و E نشاندهنده ضایعهای است که در حال برجسته شدن، تکامل یا بزرگ شدن است.
هنگامی که بیماری با ضایعهای که نشاندهنده ملانوما است مراجعه میکند، علاوه بر بیوپسی، باید معاینه فیزیکی کاملی با تأکید ویژه بر پوست (از جمله پوست سر، فضای بین انگشتی و نواحی چیندار)، حوضچههای غدد لنفاوی و بافتهای زیر جلدی انجام شود (همچنین به بخش «مرحلهبندی» در زیر مراجعه کنید).
تشخیص
انتخاب تکنیک بیوپسی بسته به محل آناتومیک و همچنین اندازه و شکل ضایعه متفاوت است. باید توجه ویژهای به تأثیر بیوپسی بر درمان قطعی جراحی شود. بیوپسی برشی یا بیوپسی برشی با استفاده از چاقوی جراحی یا پانچ قابل قبول است. برداشتن کامل ضایعه معمولاً برای ارزیابی دقیق پاتولوژیک ترجیح داده میشود. بیوپسی پانچ را میتوان برای اکثر ضایعات انجام داد. بهطورکلی، این بیوپسیها میتوانند زمانی انجام شوند که ضایعات در مناطقی قرار دارند که حفظ حداکثری پوست اطراف مهم است، یا میتوان آنها را بهطور کامل با پانچ برداشت. بیوپسی پانچ باید در برجستهترین یا تیرهترین ناحیه ضایعه انجام شود تا از تهاجمیترین ناحیه ملانوم بالقوه نمونهبرداری شود. برای اطمینان از مرحلهبندی دقیق ضایعه، باید بیوپسی تمامضخامت در بافت زیرجلدی انجام شود (به بخش دستهبندی T در ادامه این فصل مراجعه کنید).
بیوپسی برداشتی به پاتولوژیست این امکان را میدهد که در مواردی که ضایعه برای پانچ خیلی بزرگ است، اما همچنان میتوان آن را بدون مداخله جراحی بیش از حد برداشت، به دقت عمل کند. برای بیوپسیهای برداشتی، حاشیه باریکی از پوست با ظاهر طبیعی (1 تا 3 میلیمتر) همراه با نمونه برداشته میشود. اغلب از یک برش بیضیشکل برای تسهیل بسته شدن استفاده میشود. برش بیوپسی باید جهتدار باشد تا برداشت وسیع بعدی (مثلاً به صورت محوری روی اندامها) را تسهیل کند و نیاز به پیوند پوست برای بستن زخم در زمان برداشت وسیع را به حداقل برساند.
اگر تشخیص ملانوما مد نظر باشد، بیوپسی تراشیدنی عموماً توصیه نمیشود زیرا اگر حاشیه عمیق پاک نشود، ممکن است ارزیابی ناقصی از ضخامت تومور ایجاد شود. اگر بیوپسی تراشیدنی انجام شود، تراشیدن عمیق ترجیح داده میشود.
به طور کلی، ما تمام ضایعات رنگدانهای را برای معاینه دائمی ارسال میکنیم و جراحی قطعی را در زمان دیگری انجام میدهیم. ما معمولاً بیوپسی آسپیراسیون با سوزن ظریف با هدایت تصویر را به عنوان یک مانور تشخیصی اولیه برای اثبات متاستازهای غدد لنفاوی یا سایر ملانومها ترجیح میدهیم، اما نه برای تشخیص ملانومهای اولیه.
پاتولوژی
یک متخصص پوست باتجربه عضو مهمی از تیم چند رشتهای ملانوم است و به تشخیص دقیق و مرحلهبندی بیماران مبتلا به ملانوم کمک میکند. رویه ما این است که بیوپسیهای خارجی پس از ارجاع توسط کارکنان پاتولوژی ما بررسی شوند تا تشخیص تأیید شود. اگرچه تجزیه و تحلیل پاتولوژیک در درجه اول شامل بررسی میکروسکوپی تومور رنگآمیزی شده با هماتوکسیلین و ائوزین است، چندین نشانگر سلول ملانوسیتی نیز ممکن است برای تأیید تشخیص مفید باشند. دو آنتیبادی که به طور گسترده در ارزیابیهای ایمونوهیستوشیمی استفاده شدهاند، S-100 و HMB-45 هستند. S-100 نه تنها توسط بیش از 90٪ از ملانوماها، بلکه توسط چندین تومور دیگر و برخی از بافتهای طبیعی، از جمله سلولهای دندریتیک نیز بیان میشود. در مقابل، آنتیبادی مونوکلونال HMB-45 برای سلولهای ملانوسیتی تکثیری و ملانوما نسبتاً اختصاصی (اما نه به اندازه کافی حساس) است. بنابراین، اغلب به عنوان یک رنگآمیزی تأییدی هنگام بررسی تشخیص ملانوما استفاده میشود.
همچنین نشان داده شده است که رنگآمیزی Anti-MART-1 در تشخیص ملانوما بسیار مفید است. اجزای اصلی هیستومورفولوژیکی که باید در گزارش پاتولوژی ملانوما اولیه گنجانده شوند عبارتند از: ضخامت برسلو، وضعیت زخم، وضعیت حاشیه محیطی و عمقی و میزان میتوز (دومی با استفاده از رویکرد نقطه داغ پوستی با واحدهای میتوز در هر میلیمتر مربع). سایر ویژگیهایی که اغلب ثبت میشوند عبارتند از: وجود میکروساتلیتها، زیرگروه بافتشناسی، تهاجم لنفوواسکولار، لنفوسیتهای نفوذکننده تومور (TIL)، رگرسیون، نوروتروپیسم، فاز رشد و عدم وجود جزء اپیدرمی (زیرا مورد دوم ممکن است نشان دهنده یک رسوب اولیه پوستی غیرمعمول یا متاستاتیک باشد).
انواع اصلی هیستومورفولوژیکی ملانوما در زیر شرح داده شده است. اگرچه ملانوما به طور سنتی با استفاده از این دستهها توصیف شده است، اما پیشآگهی آن بیشتر به مرحلهبندی بستگی دارد تا به این انواع هیستومورفولوژیکی.
- ملانوماهای با گسترش سطحی، اکثریت ملانوماها را تشکیل میدهند (تقریباً 70٪) و عموماً در یک خال از پیش موجود ایجاد میشوند.
- ملانوماهای ندولار دومین نوع شایع هستند (15٪ تا 30٪). ملانوماهای ندولار سریعتر از سایر انواع به سمت تهاجمی شدن پیش میروند. با این حال، هنگامی که عمق ملانوما کنترل شود، ملانوماهای ندولار عموماً با پیشآگهی مشابه سایر ضایعات همراه هستند.
- ملانوماهای لنتیگو مالیگنا درصد کمی از ملانوماها را تشکیل میدهند (4٪ تا 10٪). این ضایعات در نواحی در معرض آفتاب رخ میدهند.
ملانوماهای لنتیگو مالیگنا به طور کلاسیک در صورت زنان سفیدپوست مسنتر قرار دارند. به طور کلی، ملانومهای لنتیگو مالیگنا، ضایعات بزرگ (بیش از ۳ سانتیمتر در زمان تشخیص) و مسطح هستند و در افراد زیر ۵۰ سال نادر میباشند. با توجه به ظاهر اغلب نامشخص آنها، کنترل حاشیه گاهی اوقات میتواند در زمان برداشتن گسترده، چالش برانگیز باشد.
۴. ملانومهای لنتیگو آکرال در کف دستها (پالمار)، کف پا (پلانتار) یا زیر بستر ناخنها (زیر ناخن) رخ میدهند، اگرچه همه ملانومهای کف دست، کف پا و زیر ناخن، ملانومهای لنتیگو آکرال نیستند. این ملانوماها تنها ۲٪ تا ۸٪ از ملانوماها را در بیماران سفیدپوست تشکیل میدهند، اما نسبت قابل توجهی بالاتر از ملانوماها (۳۵٪ تا ۶۰٪) را در بیماران با پوست تیرهتر تشکیل میدهند. آنها اغلب بزرگ هستند و قطر متوسط آنها تقریباً ۳ سانتیمتر است.
۵. ملانوماهای آملانوتیک، ملانوماهای نسبتاً نادری هستند که بدون تغییرات رنگدانهای رخ میدهند. تشخیص آنها اغلب به دلیل عدم وجود رنگدانه دشوارتر است. عواملی مانند تغییر در اندازه، عدم تقارن و مرزهای نامنظم ممکن است نشان دهنده بدخیمی باشد و بیوپسی را ضروری کند، اما گاهی اوقات ممکن است تأخیر در تشخیص مشاهده شود.
همبستگیهای مورفوژنتیک و جهشها در ملانوما
علاوه بر توصیفات کلاسیک ملانوماها، توانایی انجام پروفایل مولکولی روی تومورها به درک ما از این بیماری پیچیده و اغلب ناهمگن افزوده است.
اگرچه در حال حاضر به طور کلی به عنوان بخشی از مرحلهبندی اولیه ملانوما گزارش نشده است، اما پیشرفتهای پروفایل ژنتیکی در فناوری، تجزیه و تحلیل جهش را به طور معمول از بافت بایگانی شده در پارافین فیکس شده با فرمالین انجام میدهد. این امر منجر به بینشهای جدیدی در مورد پاتوژنز این بیماری و همچنین استراتژیهای درمانی عملی علیه ناهنجاریهای مولکولی خاص، به ویژه در شرایط بیماری غیرقابل جراحی و پیشرفته، شده است. مطالعات اخیر نشان میدهد که اکثر ملانوماها دارای یک یا چند جهش در مسیرهای سیگنالینگ کیناز ضروری هستند.
مسیر سیگنالینگ کیناز RAS-RAF-MEK-ERK در ملانوما مهم است. مطالعات به طور مداوم نشان دادهاند که 40 تا 50 درصد از ملانوماهای پوستی (به ویژه ملانوما با گسترش سطحی) دارای جهش در یک عضو خاص از خانواده RAF به نام BRAF هستند. اگرچه جهشهای متعدد BRAF شناسایی شدهاند، تقریباً ۹۰٪ شامل یک جهش نقطهای در V600E هستند که منجر به افزایش تقریباً ۴۰۰ برابری فعالیت پروتئین BRAF میشود. جالب توجه است که ۷۰٪ تا ۸۰٪ از خالهای خوشخیم نیز دارای جهشهای BRAF هستند، که نشان میدهد تغییرات ژنتیکی به تنهایی نمیتوانند زیستشناسی تهاجمی ملانوما را به طور کامل توضیح دهند. در همان مسیر کیناز، تقریباً ۱۵٪ تا ۲۶٪ از ملانوماها دارای جهش فعالکننده NRAS هستند. تجزیه و تحلیل مولکولی جامع ملانوما پوستی توسط پروژه ملانوما اطلس ژنوم سرطان (TCGA) بینشهای جدیدی در مورد نقشها و فراوانی ژنهای سرطانی جهشیافته و سایر امضاهای ژنومی ارائه داده است. این یافتهها به اثبات این امر کمک کرد که ملانوما پوستی را میتوان به یکی از چهار زیرگروه گروهبندی کرد: جهش BRAF (شایعترین)، جهش RAS، جهش NF1 و سهگانه WT (نوع وحشی). جالب توجه است که جهشهای BRAF و NRAS به ندرت به طور همزمان در یک تومور ملانوما شناسایی میشوند. پروتئین همولوگ فسفاتاز و تنسین (PTEN) به طور گسترده در سراسر بدن انسان بیان میشود. PTEN به عنوان یک فسفاتاز برای دفسفریله کردن فسفاتیدیل اینوزیتول (3،4،5)-تری فسفات عمل میکند. مسیر PI3 کیناز-AKT شایعترین مسیر کینازی است که در سرطان جهش یافته است. PTEN فعال شدن AKT را مهار میکند. بنابراین، از دست دادن PTEN منجر به فعال شدن دائمی مسیر AKT میشود. اغلب، از دست دادن PTEN همزمان با جهشهای NRAS یافت میشود. جهش در AKT نیز در ملانوما شناسایی شده است. در حالی که جهشهای مسیر سیگنالینگ MAP کیناز معمولاً در ملانوماهای پوستی ناشی از نواحی در معرض آفتاب یافت میشوند، در ملانوماهای لنتیجینوس مخاطی و آکرال نادر هستند. یک جهش missense در ژن c-KIT در بیش از 20٪ از ملانومهای مخاطی و بیش از 10٪ از ملانومهای لنتیجینوس آکرال یافت شده است.
مرحلهبندی
سیستم مرحلهبندی ملانوم به موازات درک ما از این بیماری پیچیده، همچنان در حال تکامل است. سیستم مرحلهبندی ملانوم AJCC نسخه هشتم اخیراً منتشر شده است. AJCC پزشکان را تشویق میکند تا از سال 2017 از این سیستم مرحلهبندی اصلاحشده برای مراقبتهای بالینی استفاده کنند، اگرچه این سیستم مرحلهبندی ملانوم اصلاحشده (نسخه هشتم) از ژانویه 2018 به صورت ملی برای ثبتکنندگان تومور اعمال خواهد شد. برخی از ویژگیهای کلیدی سیستم مرحلهبندی نسخه هشتم شامل اصلاحاتی در زیرگروه T1، ادغام دقیقتر بیماریهای اقماری، در حال عبور و ریزاقماری در دسته N و اصلاح و گسترش زیرگروههای M1 (که در زیر توضیح داده شده است) است.
دسته T
ضخامت تومور برسلو و زخم شدن تومور همچنان عوامل پیشآگهی غالب در دسته T هستند. ضخامت تومور برسلو، که بر حسب میلیمتر اندازهگیری شده و در ویرایش هشتم با دقت یکدهم میلیمتر گزارش شده است، با استفاده از یک میکرومتر چشمی برای اندازهگیری ارتفاع عمودی کل ملانوما از لایه دانهای تا ناحیه عمیقترین نفوذ تعیین میشود. از نظر تاریخی، سطح تهاجم کلارک با ارزیابی میزان نفوذ به درم تعیین میشد. دادههای آیندهنگر تأیید میکنند که اندازهگیری ضخامت تومور برسلو نسبت به اندازهگیری سطح کلارک تکرارپذیرتر است و ضخامت تومور برسلو پیشبینیکننده دقیقتری برای نتیجه است. هیئت متخصصان ملانوم AJCC همچنان از نقاط برش ضخامت تومور برسلو 1، 2 و 4 میلیمتر برای دستههای T استفاده میکند (جدول 3.1). با این حال، در ویرایش هشتم سیستم مرحلهبندی AJCC، برخلاف گنجاندن قبلی میتوزها (فقط به عنوان یک متغیر دوگانه، یعنی کمتر از ۱ میتوز در میلیمتر مربع در مقابل حداقل ۱ میتوز در میلیمتر مربع که به ترتیب در تعریف T1a و T1b نقش داشت) در زیرگروهبندی تومورهای T1، یک لایه با ضخامت تومور ۰.۸ میلیمتر نقش پیشآگهی کلیدی ایفا میکند. در ویرایش هفتم، به طور خاص، ملانومهای اولیه با ضخامت تومور کمتر از ۰.۸ میلیمتر بدون زخم، T1a نامیده میشوند، در حالی که ملانومهای اولیه ۰.۸ تا ۱.۰ میلیمتر یا آنهایی که کمتر از ۰.۸ میلیمتر با زخم دارند، به عنوان T1b طبقهبندی میشوند. علیرغم حذف آن از دسته T برای ملانومهای نازک، AJCC اهمیت پیشآگهی نرخ میتوزی را در تمام ضایعات T1-4 به رسمیت میشناسد و خاطرنشان میکند که این متغیر کمکی مهم باید ثبت شود (به عنوان تعداد میتوز در میلیمتر مربع)، زیرا احتمالاً در توسعه ابزارهای بالینی و مدلهای پیشآگهی معاصر گنجانده خواهد شد.
ملانوم همچنین ممکن است به صورت متاستاز به یک حوضه گرهای منطقهای یا حتی با بیماری متاستاتیک دوردست، اما بدون شواهدی از ضایعه اولیه، بروز کند. هنگامی که هیچ شواهدی از تومور اولیه وجود ندارد (یعنی ملانوم اولیه ناشناخته یا کاملاً پسرفت کرده) یا زمانی که ضخامت قابل ارزیابی نیست، AJCC (ویرایش هشتم) این موارد را به ترتیب به عنوان T0 و TX طبقهبندی میکند.
| جدول3.1تعریف دسته T – ویرایش هشتم AJCC سیستم مرحلهبندی ملانوما |
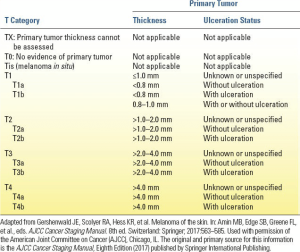 |
زخم شدن تومور اولیه از نظر هیستوپاتولوژیک به عنوان عدم وجود اپیدرم سالم که بخشی از تومور اولیه را پوشانده است، تعریف میشود. نکته مهم این است که ملانومهای زخمی با پیشآگهی به مراتب بدتری نسبت به ملانومهای غیر زخمی با ضخامت یکسان همراه هستند. در دسته T سیستم مرحلهبندی AJCC، تومورهای زخمی با b بعد از T عددی مشخص میشوند. یک استثنا برای این قانون، ملانوم اولیه غیر زخمی با ضخامت تومور 0.8 تا 1 میلیمتر است؛ که آن نیز با “b” (T1b) مشخص میشود.
دسته N
دسته N به متاستازهای ملانوما به حوزههای غدد لنفاوی منطقهای و سایر تظاهرات داخل لنفاوی متاستاز ملانوما (مانند بیماری در حال انتقال، ماهوارهای و میکروستلایت) اشاره دارد (جدول 3.2). بار تومور غدد لنفاوی منطقهای مهمترین پیشبینیکننده بقا در بیماران بدون بیماری دوردست است. به طور کلی، ناهمگونی قابل توجهی در پیشآگهی در بین بیماران مبتلا به بیماری منطقهای وجود دارد.
مطالعات متعدد نشان دادهاند که تعداد غدد لنفاوی درگیر از نظر پاتولوژیکی، پیشبینیکننده غالب و مستقل نتیجه در بیماران مبتلا به ملانوما است. سیستم مرحلهبندی AJCC نسخه هشتم همچنان از 1، 2 تا 3 و 4 یا بیشتر غدد لنفاوی منطقهای برای ایجاد زیرگروههای N استفاده میکند. همچنین نشان داده شده است که وجود زخم اولیه تومور یک عامل پیشآگهی نامطلوب مستقل در بین بیماران مبتلا به بیماری غدد لنفاوی منطقهای است که منجر به ادامه ادغام آن در سیستم مرحلهبندی ملانوما میشود. در نسخه هشتم، هم ضخامت تومور اولیه و هم زخم برای تعریف گروههای مرحله N استفاده میشوند.
| جدول 3.2 تعریف دسته N—نسخه هشتم AJCC سیستم مرحله بندی ملانوما |
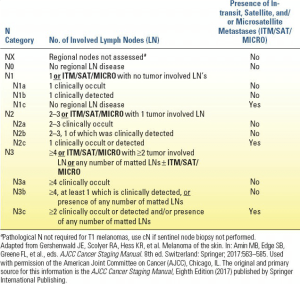 |
گذشته از تعداد غدد لنفاوی درگیر تومور، تشخیص بار بیماری غدد لنفاوی و همچنین وجود یا عدم وجود بیماری در حال انتقال، اقماری و/یا ریزاقماری مهم است. تعاریف تجربی قبلی مانند بیماری غدد لنفاوی منطقهای میکروسکوپی و ماکروسکوپی به ترتیب با بیماری غدد لنفاوی منطقهای «مخفی بالینی» یا «تشخیص بالینی» جایگزین شدهاند. بیمارانی که غدد لنفاوی منطقهای از نظر بالینی منفی دارند اما متاستازهای غدد لنفاوی از نظر پاتولوژیک (یعنی یک غده نگهبان مثبت) دارند، به عنوان متاستازهای غدد لنفاوی «مخفی بالینی» تعریف میشوند (با حرف a در دسته N مشخص میشوند). در مقابل، بیمارانی که شواهد بالینی متاستازهای غدد لنفاوی منطقهای دارند که در معاینه پاتولوژیک تأیید شده است، به عنوان متاستازهای غدد لنفاوی «تشخیص بالینی» تعریف میشوند (با حرف b در دسته N مشخص میشوند). به طور کلی، بقای بیماران مبتلا به بیماری غدد لنفاوی تشخیص داده شده بالینی بدتر از بیماران مبتلا به بیماری غدد لنفاوی مخفی بالینی است. اجزای اضافی دسته N شامل بیماری ماهوارهای، در حال انتقال یا میکروستلایت است؛ وجود حداقل یکی از این انواع متاستاز با پسوند “c” در دسته N ویرایش هشتم کدگذاری شده و بر اساس تعداد غدد لنفاوی منطقهای درگیر تومور (یعنی N1c، N2c یا N3c) طبقهبندی میشود. متاستازهای ماهوارهای و در حال انتقال به طور کلاسیک به عنوان ضایعات پوستی یا زیر جلدی در فاصله 2 سانتیمتر از تومور اولیه یا بیش از 2 سانتیمتر از ملانوم اولیه تعریف میشوند، اما عموماً فراتر از حوضه گرهای منطقهای نیستند و انواع متاستاز منطقهای غیر گرهای هستند. میکروستلایتها به عنوان هر کانونی از سلولهای تومور متاستاتیک در مجاورت یا عمق و ناپیوسته از تومور اولیه تعریف میشوند. مهم است که عنصری از بافت میانی طبیعی وجود داشته باشد، یعنی اگر فقط فیبروز و/یا التهاب یک میکروستلایت مشکوک را از اولیه آن جدا میکند، باید بررسی شود که این نشان دهنده پسرفت این ناحیه مداخلهگر است. ریزماهوارهها همچنین در سیستم مرحلهبندی دسته N گنجانده شدهاند (همچنین به بخش مدیریت بیماریهای غیر گرهای موضعی مراجعه کنید) (جدول 3.2).
دسته M
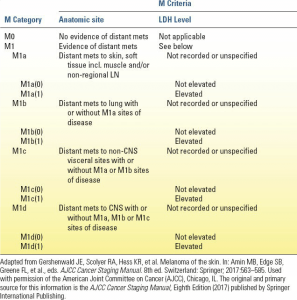
دسته M به متاستاز دوردست ملانوما اشاره دارد و به عنوان مرحله IV طبقهبندی میشود. در دسته M، فقط یک مرحله وجود دارد، M1. برخلاف سه زیردسته M در ویرایش هفتم (M1a، M1b و M1c)، در سیستم مرحلهبندی ملانوما AJCC ویرایش هشتم چهار زیردسته وجود دارد (جدول 3.3). متاستازهای دوردست به پوست، بافت زیرجلدی یا غدد لنفاوی دوردست M1a نامیده میشوند. آنها با پیشآگهی بهتری نسبت به متاستاز به سایر نقاط آناتومیک همراه هستند. متاستاز به ریهها با پیشآگهی متوسط همراه هستند و M1b نامیده میشوند. متاستازهای احشایی با پیشآگهی بدتری همراه هستند و M1c نامیده میشوند. مورد جدید در ویرایش هشتم، اضافه شدن یک زیرگروه برای متاستاز CNS (یعنی مغز، نخاع و/یا بیماری لپتومننژیال) است که M1d نامیده میشود. این دسته از بیماریها عموماً در مقایسه با سایر دستههای M با بقای بدتری همراه است. M1c اکنون شامل بیمارانی با متاستاز احشایی غیر CNS نیز میشود. این زیرگروهها، تفاوتهای بقا را در بین بیماران مبتلا به بیماری متاستاتیک، بسته به محل آناتومیک متاستازها، منعکس میکنند.
سطح لاکتات دهیدروژناز سرم (LDH) نیز همچنان در دسته M قرار میگیرد. نشان داده شده است که LDH بالا بر بقا در بیماران مبتلا به بیماری مرحله IV تأثیر منفی میگذارد. سطح LDH در بیمارانی که سطح LDH آنها بالا نیست با پسوند (0) یا برای بیمارانی که LDH بالایی دارند با (1) نشان داده میشود (یعنی M1a(1) …M1d(1)). در بیمارانی که سطح LDH آنها ناشناخته یا نامشخص است، هیچ پسوندی اضافه نمیشود (جدول 3.3).
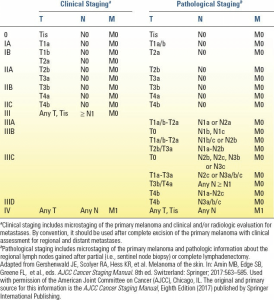
مرحلهبندی کلینیکوپاتولوژیک (c/pTNM)
مرحلهبندی بالینی شامل ویژگیهای ذکر شده در بالا از تومور اولیه و همچنین ضایعات و مطالعات بالینی و/یا رادیولوژیک است. مرحلهبندی پاتولوژیک شامل گنجاندن تمام متغیرهای مرحلهبندی میکروسکوپی تومور اولیه و همچنین اطلاعات حاصل از نمونه جراحی، از جمله اثر درمان و وضعیت حاشیه است. وضعیت غدد لنفاوی با شناسایی و تعیین مقدار درگیری غدد لنفاوی نگهبان و/یا ناحیهای تایید میشود. مرحلهبندی پاتولوژیک رسمی برای طبقهبندی صحیح و پیشبینی نتیجه بیمار بسیار مهم است (جدول 3.4).
| جدول 3.3تعریف دسته M—نسخه هشتم AJCC سیستم مرحله بندی ملانوما |
 |
ارزیابی وسعت بیماری
علاوه بر معاینه فیزیکی، از چندین روش کمکی برای تعیین وسعت بیماری استفاده میشود. شبکه ملی جامع سرطان (NCCN) دستورالعملهایی را برای ارزیابی ملانوم متاستاتیک احتمالی با تصویربرداری ارائه میدهد. برای ملانوم درجا، مطالعات تصویربرداری توصیه نمیشود. برای ملانوم مراحل I-II، تصویربرداری فقط در صورتی توصیه میشود که علائم یا نشانههای خاصی وجود داشته باشد که نیاز به ارزیابی داشته باشند. برای ملانوم مرحله III، روش کلی ما در MD Anderson این است که تصویربرداری پایه را با عکسبرداری از قفسه سینه، اسکن توموگرافی کامپیوتری، PET/CT و/یا تصویربرداری رزونانس مغناطیسی (MRI) مغز انجام دهیم. سونوگرافی با آسپیراسیون با سوزن ظریف از حوضههای غدد لنفاوی مرتبط ممکن است در تشخیص بیماری متاستاتیک در غدد لنفاوی مفید باشد. بیوپسی اکسیزیونال و/یا برداشتن رسمی غدد مشکوک صرفاً برای اهداف تشخیصی توصیه نمیشود. بیمارانی که مشکوک به مرحله چهارم بیماری هستند، معمولاً با توموگرافی کامپیوتری (CT) قفسه سینه، شکم و لگن ± توموگرافی انتشار پوزیترون (PET) و همچنین MRI مغز، مرحلهبندی میشوند. بیوپسی از طریق پوست با هدایت تصویر از ضایعات مربوطه میتواند برای تأیید بیماری استفاده شود؛ بیوپسی برداشتی از ضایعات متاستاتیک مشکوک به ندرت برای اهداف تشخیصی تجویز میشود.
| جدول 3.4گروههای مرحله-نسخه هشتم AJCC ملانوما سیستم صحنه سازی |
 |
مدیریت ملانوم اولیه
کنترل موضعی ملانوم اولیه نیازمند برداشتن وسیع تومور یا محل بیوپسی – تا پایین فاسیای عمیق اما نه شامل آن – با حاشیهای از پوست به ظاهر طبیعی است (شکل 3.1). حاشیه جراحی معمولاً از لبه محل بیوپسی یا جزء سالم باقیمانده ضایعه اندازهگیری میشود. خطر عود موضعی بیشتر با ضخامت تومور مرتبط است تا با حاشیههای برداشتن جراحی. بنابراین، منطقی است که حاشیههای جراحی را بر اساس ضخامت تومور بر اساس نتایج آزمایشهای بالینی متعدد در چند دهه گذشته تغییر دهیم. پهنای حاشیه از نظر تاریخی، حتی ملانومهای نازک نیز با حاشیههای بسیار پهن (3 تا 5 سانتیمتر) برداشته میشدند. با این حال، مطالعات نشان دادهاند که حاشیههای باریکتر اغلب با همان میزان عود حاشیههای پهنتر مرتبط هستند.
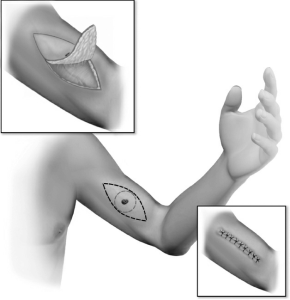 |
| شکل ۳.۱ برش وسیع ملانوما. حاشیه شعاعی مناسب به صورت شماتیک (تصویر مرکزی، خط نقطهچین خاکستری روشن) به همراه برش بیضوی با جهتگیری محوری مناسب برای تسهیل بسته شدن اولیه (تصویر داخلی، پایین سمت راست) پس از برش وسیع (تصویر داخلی، بالا سمت چپ) (با تشکر از Gershenwald JE، هوستون، تگزاس. حق چاپ محفوظ است برای Gershenwald و مرکز سرطان دانشگاه تگزاس MD Anderson). |
اولین مطالعه تصادفی شامل حاشیههای جراحی برای ملانومهای با ضخامت کمتر از ۲ میلیمتر توسط گروه ملانوم سازمان بهداشت جهانی گزارش شد. در بهروزرسانی این مطالعه که شامل ۶۱۲ بیمار بود که به طور تصادفی به دو گروه ۱ سانتیمتر یا ۳ سانتیمتر حاشیه برش تقسیم شدند، هیچ عود موضعی در بین بیماران مبتلا به ملانومهای اولیه نازکتر از ۱ میلیمتر مشاهده نشد. در بین ۱۰۰ بیمار مبتلا به ملانوم با ضخامت ۱ تا ۲ میلیمتر، چهار عود موضعی وجود داشت و هر چهار مورد در بیمارانی با حاشیه ۱ سانتیمتر رخ داد. هیچ تفاوت معنیداری در میزان بقا بین گروههای حاشیه جراحی ۱ و ۳ سانتیمتر وجود نداشت.
این نتایج نشان میدهد که حاشیه برش ۱ سانتیمتر برای ملانومهای نازک (ضخامت کمتر از ۱ میلیمتر) ایمن است. یک کارآزمایی تصادفی آیندهنگر چند نهادی از فرانسه، حاشیههای برش ۲ و ۵ سانتیمتر را در ۳۶۲ بیمار مبتلا به ملانوم با ضخامت کمتر از ۲ میلیمتر مقایسه کرد. هیچ تفاوتی در میزان عود موضعی یا بقا بین دو گروه وجود نداشت. به طور مشابه، یک کارآزمایی تصادفی از سوئد، 989 بیمار مبتلا به ملانوما با ضایعات کمتر از 2 میلیمتر ضخامت را که با حاشیههای 2 و 5 سانتیمتری برداشته شده بودند، مقایسه کرد. نتایج مشابه بود. در مورد ضایعات ضخیمتر، یک کارآزمایی بالینی تصادفی از بریتانیا، کارآزمایی گروه مطالعه ملانوما بریتانیا (UKMSG)، حاشیههای برشی 1 و 3 سانتیمتری را در 900 بیمار مبتلا به ملانوما با ضخامت حداقل 2 میلیمتر مقایسه کرد. با میانگین زمان پیگیری 60 ماه، حاشیه 1 سانتیمتری با افزایش قابل توجه خطر عود موضعی-منطقهای (37٪ در مقابل 32٪ برای حاشیههای 3 سانتیمتری) همراه بود. با این حال، بقای کلی (OS) در دو گروه مشابه بود. برای ضایعات با ضخامت متوسط، یک مطالعه آیندهنگر تصادفی که توسط کمیته بینگروهی ملانوما انجام شد، حاشیههای شعاعی 2 و 4 سانتیمتری برش را برای ملانوماهای با ضخامت 1 تا 4 میلیمتر مقایسه کرد. هیچ تفاوتی در میزان عود موضعی بین دو گروه وجود نداشت. چهل و شش درصد از بیماران در گروه ۴ سانتیمتری نیاز به پیوند پوست داشتند، در حالی که تنها ۱۱ درصد از بیماران در گروه ۲ سانتیمتری نیاز به پیوند پوست داشتند (P < 0.001). با این حال، شایان ذکر است که روندی برای بهبود بقای ۱۰ ساله مختص بیماری در حاشیههای ۴ سانتیمتری (۷۷٪) در مقابل حاشیههای ۲ سانتیمتری (۷۰٪) مشاهده شد. یک کارآزمایی بالینی که مستقیماً حاشیههای ۱ و ۲ سانتیمتری را برای ملانومهای ۱ تا ۲ میلیمتری مقایسه کند، انجام نشده است. بر اساس دادههای کارآزمایی WHO و کارآزمایی بین گروهی ملانوم، حاشیههای ۲ سانتیمتری زمانی توصیه میشوند که محل آناتومیک مطلوب باشد و بسته شدن اولیه قابل دستیابی باشد. از آنجایی که هیچ مزیت بقا قابل اثباتی برای حاشیه ۲ سانتیمتری نسبت به حاشیه ۱ سانتیمتری در ملانومهای ۱ تا ۲ میلیمتری وجود ندارد، حاشیه ۱ سانتیمتری را میتوان در مواردی که حاشیه ۲ سانتیمتری به راحتی قابل دستیابی نیست، توجیه کرد.
عرض بهینه حاشیه برای ملانومهای ضخیم (>۴ میلیمتر) هنوز ناشناخته است. یک بررسی گذشتهنگر از ۲۷۸ بیمار مبتلا به ملانومهای اولیه ضخیم از مرکز سرطان MD Anderson دانشگاه تگزاس و مرکز سرطان Moffitt نشان داد که عرض حاشیه برش (≤۲ سانتیمتر در مقابل >۲ سانتیمتر) پس از پیگیری متوسط ۲۷ ماهه، تأثیر قابل توجهی بر عود موضعی، بقای بدون بیماری یا میزان بقای کلی (OS) نداشت.
علاوه بر این، بر اساس دادههای کارآزمایی UKMSG (محققان نتیجه گرفتند که حاشیه ۳ سانتیمتر برای ملانومهایی با ضخامت ۲ تا ۴ میلیمتر بهتر از حاشیه ۱ سانتیمتر است) و کارآزمایی بین گروهی ملانوم (حاشیه ۴ سانتیمتر برای ضخامت تومور یکسان، نسبت به حاشیه ۲ سانتیمتر برتری ندارد)، حاشیه بزرگتر از ۲ سانتیمتر برای این ملانومهای ضخیم ضروری نیست.
بر اساس دادههای کارآزماییهای تصادفی و آیندهنگر، میتوان چندین توصیه برای حاشیههای برش ارائه داد (جدول ۳.۵). در مورد بیماران مبتلا به ملانوم درجا، حاشیه ۰.۵ سانتیمتر تا ۱ سانتیمتر کافی است.
بیماران مبتلا به ملانوم تهاجمی با ضخامت کمتر از ۱ میلیمتر را میتوان با حاشیه ۱ سانتیمتر از برش درمان کرد. برای بیماران مبتلا به ملانوم با ضخامت ۱ تا ۲ میلیمتر، ارائه یک توصیه ساده دشوار است زیرا این جمعیت بیمار در چندین کارآزمایی که طیف وسیعی از حاشیههای برش را ارزیابی میکنند، مورد مطالعه قرار گرفتهاند. به طور کلی، اگر از نظر آناتومیک و عملکردی امکانپذیر باشد، حاشیه ۲ سانتیمتر ترجیح داده میشود و در مناطقی که محدودیت آناتومیک دارند (مثلاً صورت)، حاشیه ۱ سانتیمتر کافی است. این توصیه بر اساس این واقعیت است که میزان بقای کلی برای بیماران با حاشیه ۱ و ۳ سانتیمتر در کارآزمایی سازمان بهداشت جهانی مشابه بود. بیماران مبتلا به ملانوم با ضخامت ۲ تا ۴ میلیمتر را میتوان با حاشیه ۲ سانتیمتر درمان کرد. در بیماران مبتلا به ملانوم ضخیمتر از ۴ میلیمتر، حاشیه ۲ سانتیمتر احتمالاً بیخطر است و عموماً استفاده میشود، اگرچه هیچ کارآزمایی تصادفی آیندهنگر به طور خاص به این گروه از ضخامتها نپرداخته است. اگرچه هیچ کارآزمایی تصادفی آیندهنگر به طور خاص به این گروه از بیماران نپرداخته است.
بستن زخم
اگر در مورد توانایی بستن مناسب زخم تردیدی وجود دارد، باید با یک جراح پلاستیک یا ترمیمی مشورت شود. گزینههای بستن زخم شامل بستن اولیه، پیوند پوست و فلپهای موضعی و دوردست است.
| جدول 3.5 خلاصهای از توصیهها برای حاشیههای برش ملانوم اولیه |
 |
بستن اولیه روش انتخابی برای اکثر ضایعات است، اما در مواردی که ظاهر یک ویژگی متحرک صورت را تغییر شکل میدهد یا در عملکرد اختلال ایجاد میکند، باید از آن اجتناب شود. بسیاری از نقصها را میتوان با استفاده از یک فلپ پیشرفته، که پوست و بافتهای زیر جلدی را برای امکان بستن اولیه زیر پا میگذارد، بست. بستن اولیه معمولاً مستلزم آن است که محور طولی یک برش بیضوی تقریباً سه برابر طول محور کوتاه باشد.
پوست و بافت زیر جلدی تا پایین برداشته میشوند، اما عموماً شامل فاسیا نمیشوند. بستن لبههای زخم معمولاً در دو لایه انجام میشود – یک لایه پوستی از بخیههای قابل جذب رنگ نشده 3-0 یا 4-0 و یا بستن پوست منقطع با استفاده از بخیههای غیرقابل جذب 3-0 یا 4-0 یا بستن پوست زیر جلدی مداوم با استفاده از بخیههای قابل جذب تک رشتهای 4-0. گاهی اوقات از سه لایه استفاده میشود، به ویژه برای ملانومهای اولیه پشت. پس از برداشتن، نمونه باید برای ارزیابی دائمی حاشیههای بافتشناسی جهتگیری شود. استفاده از پیوند پوست یکی از سادهترین روشهای ترمیمی مورد استفاده برای بستن زخم است. پیوند پوست با ضخامت جداشونده (split-thickness) رایجترین روش است. برای ضایعات اولیه اندام تحتانی، پیوندهای پوست با ضخامت جداشونده باید از اندام مقابل گرفته شوند. به طور کلی، پیوندهای پوست باید از ناحیهای دور از ملانوم اولیه و خارج از منطقه متاستاز احتمالی در حال انتقال گرفته شوند. پیوند پوست با ضخامت کامل میتواند نتیجهای را ارائه دهد که هم بادوامتر و هم از نظر زیباییشناسی کیفیت بالاتری نسبت به پیوند با ضخامت جداشونده داشته باشد. پیوندهای تمامضخامت معمولاً روی صورت استفاده شدهاند، جایی که ملاحظات زیباییشناسی بیشترین اهمیت را دارند. محلهای اهداکننده برای پیوند پوست با ضخامت کامل به صورت باید از مکانهایی انتخاب شوند که احتمالاً با رنگ صورت مطابقت دارند، مانند پوست پشت گوش یا جلوی گوش یا قسمت بالای ترقوه گردن.
فلپهای موضعی مزایای بیشماری برای ترمیم نقصهایی دارند که نمیتوانند در درجه اول بسته شوند، به خصوص در اندامهای انتهایی و روی سر و گردن. تطابق رنگ عالی است، دوام پوست اساساً طبیعی است و حس طبیعی معمولاً حفظ میشود. فلپهای جابجایی و فلپهای چرخشی از انواع مختلف با موفقیت مورد استفاده قرار گرفتهاند، اگرچه برای بیمارانی که خطر بالای متاستاز در حین انتقال دارند، بازسازی گسترده فلپ ممکن است به طور قابل توجهی لنفاوی منطقهای را تغییر دهد. فلپهای دوردست ممکن است در مواردی که بافت کافی برای فلپ موضعی در دسترس نیست و هنگامی که پیوند پوست پوشش کافی زخم را فراهم نمیکند، در نظر گرفته شوند. فلپهای پوستی و فلپهای آزاد میتوانند مورد استفاده قرار گیرند. با این وجود، استفاده از رویکردهای مبتنی بر VAC زخم برای تسهیل بافت گرانوله که به عنوان بستر بافت سالم برای پیوند پوست بعدی عمل میکند، اغلب میتواند نیاز به در نظر گرفتن چنین گزینه ترمیمی را برطرف کند (به عنوان مثال، ملانوما ناشی از پاشنه پا). بحث بیشتر در مورد چنین روشهای پیچیدهای فراتر از محدوده این فصل است، اما این تکنیکها برای جراحان پلاستیک و ترمیمی آشنا هستند و با جزئیات بیشتر در فصل ۲۵ مورد بحث قرار گرفتهاند.

بدون دیدگاه